研究问题“癌症干细胞”假设在乳腺癌中
Dana-Farber癌症研究所研究挑战“癌症干细胞” - 肿瘤内少量的自我更新细胞 - 是乳腺癌进展和复发的原因,并且仅擦除这些细胞可以治愈该疾病。
相反,科学家在3月份的问题上报告癌细胞他们已经确定了人乳腺肿瘤样本中的两个遗传癌细胞 - 其中一种类型的一种近期由其他科学家提出的细胞,成为真正的乳腺癌干细胞。
“如果乳腺癌细胞均来自单一癌症干细胞,您可能能够只用一种药物治愈疾病,”达娜法尔伯纸唐娜·波德,博士学位,博士,唐纳斯·帕特·帕特,兼论文。“但我们的研究结果表明肿瘤细胞来自”干燥的“祖细胞,然后渡过渡过,所以我认为你必须治疗两种细胞类型。”
结果表明,两种细胞类型和其他人都参与了乳腺癌的发展。在分析每个细胞类型的遗传时,
研究人员发现,所提出的“癌症干细胞”由活化的分子途径驱动,使它们类似于正常干细胞。乳腺肿瘤主要由这些“干细胞”细胞组成的妇女具有更高的复发风险。
波利亚克说,从积极的方面来看,这些细胞中被异常激活的途径,即TGF-Beta1信号途径,可以被正在进入临床试验的实验性药物阻断。波利亚克同时也是哈佛医学院的副教授。这种抑制剂与其他疗法联合使用,可能改善由这些细胞引发的乳腺癌的预后。
克隆演化或癌症干细胞?
根据长期的癌症模型,称为“克隆演化”,肿瘤来自突变并产生异常后代的正常细胞也产生突变,形成遗传多种癌细胞的质量。然而,在替代解释中存在新的兴趣浪潮 - 通过在例如乳腺组织中发现的单个异常类型的成年干细胞进行肿瘤和驱动,导致遗传相同的肿瘤细胞群体。此外,正常干细胞功能所需的几种途径和基因在癌细胞中被激活,并在肿瘤的发育中起着基本作用。
根据癌症干细胞假设,燃料癌症的少数自我更新干细胞难以杀死,并且它们的持续性可以解释为什么肿瘤经常在成功治疗后经常复发。
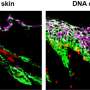
2003年,科学家们纯化了他们提出的患者肿瘤的乳腺癌干细胞。在细胞面上的独特分子或标记物,称为CD44 +,与正常乳腺细胞上的标记相同。当注射到缺乏免疫系统的小鼠时,CD44 +细胞显示出引发乳腺肿瘤的能力。科学家们还发现具有CD24 +标记的密切相关细胞,并表明它们是CD44 +细胞的后代。
由Polyak和Michail Shopitsin领导的团队,也是Dana-Farber和HMS,使用基因活动分析来澄清两种细胞类型的关系。它们从CD24 +和CD44 +细胞生成了从乳腺癌内纯化的CD24 +和CD44 +细胞的基因文库,以及从乳腺癌患者收集的主要侵入性肿瘤样本。
科学家们报道的调查结果比克隆模型更紧密地伴随着癌症干细胞假设。也就是说,CD24 +细胞与CD44 +细胞非常相似,但并不总是遗传相同 - 如果CD44 +细胞是真正的干细胞和CD24 +它们的后代,它们将一直存在。
“虽然CD44 +细胞似乎表达了许多干细胞标志物,但肿瘤内CD24 +和CD44 +细胞之间的遗传差异问题质疑乳腺癌中癌症干细胞假设的有效性,并提出涉及肿瘤内异质性作为替代解释的克隆演化,“作者写道。
此外,Polyak团队发现CD44 +细胞,但不是CD24 +细胞由活化的TFG-Beta1途径驱动。因此,他们说:“由主要由CD24 +细胞组成的肿瘤,大多数CD44 +细胞组成的肿瘤可能具有较差的临床行为,这些患者可能会受益于靶向TFG-BETA1途径的治疗。”
资料来源:Dana-Farber癌症研究所
进一步探索














用户评论