对最常见前脑畸形的新见解
圣犹大儿童研究医院的科学家们已经确定了一种被称为前脑无孔畸形(HPE)的遗传大脑畸形的分子机制。这些发现不仅让我们深入了解了新生儿最常见的前脑和面部发育畸形,也有助于理解大脑在发育中的胎儿中形成的复杂过程。
由圣犹大遗传学家吉列尔莫·奥利弗博士领导的研究人员在2008年8月11日的杂志上发表了他们的发现细胞发育.
奥利弗说:“这些发现很重要,因为,虽然导致HPE的基因已经被识别出来,但那些产生HPE的基因之间的相互作用不仅复杂,而且人们对它们的了解也很少。”“这是理解这种相互作用机制的第一步。”
每250个胎儿中就有一个发生HPE,经常导致流产或死产。每16000名新生儿中就有1名存在不同程度的HPE。这种疾病的特征是发育中的大脑无法分裂成左右半球。除了大脑异常,HPE的特征是面部畸形,如唇裂和腭裂。尽管研究人员认为,HPE也受到环境因素的影响,如孕妇糖尿病、怀孕期间感染或药物等,但HPE已被追溯到9个基因中的任何一个的突变。
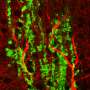
在他们的研究中,研究人员试图了解编码一种名为Six3的蛋白质的基因在HPE中的作用。在之前的研究中,奥利弗和他的同事已经发现Six3蛋白对胎儿大脑的形成至关重要。此外,其他研究也发现Six3的缺陷突变与HPE的发生有关,但他们不知道Six3促进HPE的分子机制。
6 -3在HPE中作用的一个线索来自于一个事实,即大多数引起HPE的其他基因在一个重要的分子机制中产生故障,即Sonic Hedgehog通路,这是胎儿大脑发育的一个主要调节因子。
因此,研究人员推断,Six3也可能通过损害Sonic Hedgehog途径的功能来触发HPE。在他们的第一个实验中,他们选择了斑马鱼,斑马鱼是一种广泛用于研究遗传和发育的动物模型。范德比尔特大学的论文共同作者利用斑马鱼分析了一些已知与人类HPE相关的缺陷突变Six3基因。他们发现,这些突变导致Six3基因功能的部分丧失,这是突变如何导致HPE的重要线索。
在对小鼠的研究中,奥利弗和他的同事们发现,Six3和Sonic Hedgehog通路在大脑中的同一时间和地点都很活跃,这是它们可以协同工作的重要证据。
研究人员还发现了这两个基因共同导致HPE的证据。尽管携带已知与人类HPE相关的Six3突变基因的工程小鼠只表现出偶尔的HPE症状,但当与同样具有Sonic Hedgehog基因缺陷的小鼠杂交时,所有动物都发展为严重的HPE。
奥利弗说:“这是HPE所谓的‘多重成功’模式的有力证据。”“在这个模型中,Six3和Sonic Hedgehog途径中的其他基因都发生了突变,才产生了HPE的严重病理。”
此外,研究人员的分子研究表明Six3和Sonic Hedgehog基因密切参与调节正常的大脑发育。Six3是《Sonic Hedgehog》的重要控制器;刺猬索尼克反过来影响six3的功能——两者在一个调节回路中协同工作。
奥利弗说,研究人员对Six3的作用的发现为HPE提供了关键的见解。奥利弗说:“刺猬索尼克在胚胎发育、大脑和身体其他部位都扮演着重要角色。”“因此,对它在大脑中这个非常有限的时间和地点的调节的新理解,帮助我们在分子水平上了解它在大脑形成中的一些整体作用。”
在进一步的研究中,研究人员计划利用他们对Six3和Sonic Hedgehog基因在HPE中的作用的理解,来探索为什么不同的多重基因突变组合可能会产生从轻微到严重的一系列疾病。
资料来源:圣犹大儿童研究医院