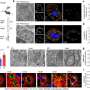
患者来源的诱导干细胞保留疾病特征
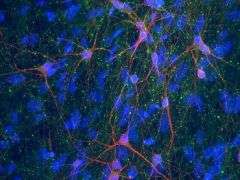
(PhysOrg.com)——当克莱夫·斯文森(Clive Svendsen)的实验室培养皿里的神经元开始死亡时,他高兴极了。这些垂死的细胞——与患有毁灭性神经系统疾病脊髓性肌萎缩症的患者失去的细胞类型相同——证实了威斯康星大学麦迪逊分校的干细胞生物学家在实验室中利用从患者身上提取的干细胞重建了一种遗传疾病的特征。通过让科学家有无与伦比的机会在实验室培养皿中观察疾病的发展过程,这项工作标志着研究和开发遗传疾病新疗法的巨大进步。
正如本周杂志上报道的那样自然斯文森和他在威斯康星大学麦迪逊分校以及密苏里大学哥伦比亚分校的同事们通过对脊髓性肌萎缩症(SMA)患者的皮肤细胞进行基因重组,创造出了疾病特异性干细胞。这种遗传性疾病是婴儿死亡最常见的遗传原因,突变导致控制骨骼肌的神经死亡,导致肌肉无力、瘫痪,最终死亡,通常发生在两岁左右。
2007年底,威斯康星大学麦迪逊分校的干细胞生物学家James Thomson和Junying Yu以及由山中真弥(Shinya Yamanaka)领导的一个日本研究小组首次报道了皮肤细胞的基因重编程,他们将细胞的发育时钟调回胚胎状态,使它们能够变成人体220种不同细胞类型中的任何一种。由此产生的诱导多能干细胞,被称为iPS细胞,利用胚胎干细胞在没有胚胎的情况下的空白发育潜力,被认为是研究发育和疾病的一种强大的潜在方法。
仅仅一年之后,这项新工作就实现了这一承诺。
“当科学家研究人类疾病时,他们通常只能观察死后受影响的组织,然后试图弄清楚疾病是如何发生的?这有点像警察到达交通事故现场——汽车在沟里,但他们不知道它是如何到达那里的,也不知道它的原因,”斯文森解释说,他是威斯康星大学麦迪逊分校医学和公共卫生学院和韦斯曼中心的解剖学和神经学教授,也是干细胞和再生医学中心的联合主任。
他说,有了iPS细胞,“现在你可以在培养皿中一遍又一遍地回放人类疾病,并询问开始这一过程的最初步骤是什么。这是一个非常强大的新工具。”
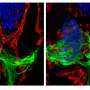
在这项新研究中,研究人员从一名年轻的SMA患者和他的母亲(没有患这种疾病)的皮肤细胞中提取了iPS细胞。这些细胞在实验室中生长良好,研究小组开发了一种新方法来有效地驱动它们产生大量的运动神经元,运动神经元是控制肌肉的细胞,在SMA中受到影响。
最初,运动神经元在两个样本中都茁壮成长。但大约一个月后,“意外开始发生,”斯文森说,来自患者来源的细胞的运动神经元开始消失。
“我们得到的运动神经元在培养中开始死亡,就像它们在疾病中一样。这是我们第一次在培养皿中模拟人类疾病,”他说。
他们现在可以开始分析是什么杀死了运动神经元,以及为什么这些细胞单独成为这种疾病的目标。这项新研究的主要作者、威斯康星大学麦迪逊分校的研究员Allison Ebert说,过去研究SMA引起突变的影响通常依赖于容易获得的皮肤细胞,这些细胞不受SMA的影响,对运动神经元死亡的方式和原因提供的见解有限。
她解释说:“如果我们开始更多地了解为什么在这种疾病中受到特别影响的运动神经元正在死亡,那么就有可能开发出新的治疗方法,在发育的早期特定时期进行干预。”目前SMA的治疗方案有限,而且无法治愈。
Ebert指出,在研究疾病方面,来自患者的iPS细胞比其他方法(包括胚胎干细胞)更具科学优势。实际上,研究人员可以观察已经发生的事故的发展,以及已知的临床结果——病人疾病的过程和严重程度——应该有助于他们了解他们在细胞中看到的变化是如何与疾病的整体情况相适应的。
“人类来源的SMA运动神经元的发展是SMA领域向前迈出的重要一步,特别是在各种治疗途径正在研究的情况下,”SMA专家、MU兽医病理生物学教授、该论文的作者克里斯蒂安·洛森(Christian Lorson)同意这一观点。“为了能够研究这些细胞的治疗活性,无论是新药、病毒载体、寡核苷酸,还是更好地了解疾病病理,iPS SMA运动神经元都代表了一个很好的疾病相关背景。”
虽然像阿尔茨海默氏症和帕金森氏症这样的复杂和晚期疾病很难用iPS细胞来建模,但研究人员说,这种方法应该为研究其他遗传疾病铺平道路,比如亨廷顿氏病。斯文森说:“我们必须找到更好的方法来模拟难以在动物身上复制的复杂人类疾病。”“iPS细胞是实现这一目标的一种很有前途的新研究工具。”
他认为威斯康星大学麦迪逊分校干细胞和再生医学中心促进了这项工作,特别是利用Yu和Thomson的专业知识,他们开创了这项技术,创造了这项研究中使用的iPS细胞。他说:“这是该中心如何在校内和校外合作,使这些事情取得成果的一个例子。”
威斯康星大学麦迪逊分校提供