研究发现了治疗一些耐药非小细胞肺癌的新药物
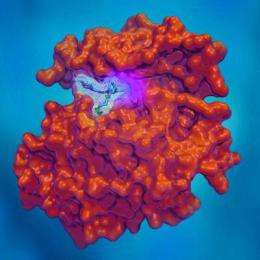
制造、测试和绘制新型抗癌药物原子结构的能力使达纳-法伯癌症研究所的科学家们发现了一种能够阻止一种常见类型的耐药肺癌的化合物。
在12月24日至31日出版的《自然》杂志上发表的一项研究中,研究人员报告说,非小细胞肺癌已经变得对药物Iressaâ和Tarcevaâ无懈可摧,但Dana-Farber实验室设计和配制的一种化合物阻止了这种癌症。这种化合物的基本化学结构与其他化合物不同抗癌药物它的作用是对抗一种叫做表皮生长因子受体(EGFR)激酶的蛋白质,这种蛋白质带有特定的结构缺陷。
“这种类型的药物发现,其中一种药剂是针对特定的基因或蛋白质目标开发的,然后进行筛选癌症细胞以及在实验室模型中,在学术医学中是罕见的,”该研究的高级作者,丹娜-法伯和布里格姆妇女医院(BWH)的医学博士Pasi A. Jänne说。“这需要多个学科的研究人员做出贡献,并采取协调一致的方法来规划实验和共享结果。我们的成就证明了学术医疗中心可以为寻求新的癌症治疗方法做出贡献。”
这项研究还说明了速度有多快肺癌研究和治疗正在取得进展。不到五年前,达纳法伯和其他地方的研究人员追踪到一些非小细胞肺癌(nsclc)的EGFR基因突变,并发现易瑞沙和特罗凯通过靶向异常的EGFR蛋白来减缓这种肿瘤的生长。虽然这一发现延长了全球数千名非小细胞肺癌患者的生命,但EGFR阻滞剂只是暂时有效:在大约8个月的治疗后,肿瘤开始重新生长。由于这些药物既针对正常的EGFR蛋白,也针对异常的EGFR蛋白,许多患者都有严重的副作用,如皮疹和腹泻。
目前所有的EGFR抑制剂都有一个结构“主干”,即喹唑啉核心。它们停留在EGFR上的一个缺口中,通常是为一种被称为ATP的分子保留的,ATP向细胞传递化学能。通过阻断ATP与EGFR的结合,抑制剂阻止了EGFR发送对保持肿瘤细胞生长至关重要的信号。
然而,随着时间的推移,肿瘤细胞在EGFR中产生额外的异常,使它们能够重新生长,即使在易瑞沙或特罗凯存在的情况下。这些异常中最常见的是EGFR T790M,约有50%的耐药肿瘤患者存在这种异常。
Dana-Farber研究人员假设,目前的药物失去了效力,因为它们没有像理想情况下那样紧密或完全结合EGFR T790M蛋白。为了提高配合度,由化学生物学家Nathanael Gray博士领导的研究人员制备了一组具有不同结构支架的抑制剂,称为嘧啶核心,被认为可以更彻底地配合。他们用EGFR T90M在NSCLC细胞中对这些药物进行了实验室测试,发现其中一些药物在限制细胞生长方面的效果比喹唑啉强100倍。作为一个意外的惊喜,这些化合物在减缓正常EGFR细胞生长方面的作用几乎是普通药物的100倍,这表明它们比现有药物产生副作用的可能性更小。表现最好的药剂是嘧啶WZ4002。
Gray说:“这项工作为长期以来验证EGFR作为药物靶点的记录提供了一个可能的治疗章节。”“这涉及到识别EGFR激活突变作为药物反应的预测因子,发现多种耐药机制,并阐明这些突变如何在原子水平上起作用。”
在后续实验中,Dana-Farber和BWH的Kwok-Kin Wong医学博士在EGFR T790M驱动的易瑞沙和特拉西瓦耐药NSCLC肿瘤小鼠中筛选了嘧啶类药物,并发现它们在阻碍肿瘤生长方面非常有效。Dana-Farber的Michael Eck医学博士进行了晶体学研究,以确定嘧啶的分子结构,为它们为什么如此有效以及如何如此精确地靶向EGFR T790M细胞提供了更好的图像。
Wong说:“我们不仅确定了化合物WZ4002可以减缓肿瘤生长,我们还证明了有可能选择性地靶向肿瘤中的耐药突变EGFR,而对健康组织中的正常EGFR影响相对较小。”
作者警告说,还有很多工作要做,以确定WZ4002及其化学表亲是否会是有效的治疗方法,但这一发现证明了筛选特殊设计的化合物对抗具有某些遗传特征的癌症的力量。
“显然,这些化合物在患者身上的可能使用还处于早期阶段,我们仍然需要了解它们可能的危害,”Eck评论道。“但我乐观地认为,我们的方法是正确的,它将为成千上万的非小儿科患者带来有效的治疗细胞肺癌全世界每年对易瑞沙和特罗凯产生耐药性的癌症患者。”
进一步探索







用户评论