研究人员说,基因治疗奠定了新治疗的阶段
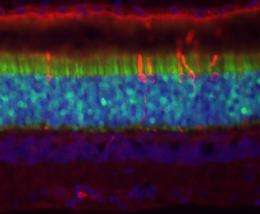
宾夕法尼亚大学(University of Pennsylvania)的兽医视觉科学家已经安全且成功地使用了一种病毒载体,以视网膜上一种称为视杆细胞的光感受器为目标,这是为视杆细胞变性导致的遗传性失明开发基因疗法的关键第一步。
在本研究中,病毒载体或导弹携带遗传物质设计用于纠正DNA突变,并非旨在治疗疾病,而是通过使用荧光蛋白质来证明安全和有效的病毒鸡尾酒可以在杆状细胞内输送。
视觉研究人员面临的下一个主要挑战是针对这些感光细胞进行治疗,因为大多数视网膜退行性疾病是由损害这些细胞的突变引起的。光感受器是细胞视网膜负责捕获光线并将其转化为电信号这将被大脑解释。
来自宾夕法尼亚州和佛罗里达大学的研究人员的联盟使用了特定的腺相关病毒AAV2 / 5,携带AAV2 / 5。绿色荧光蛋白。科学家测试了三种不同的启动子,发挥开关作用的DNA是否可以转向狗中棒中的绿色荧光蛋白的生产。三种病毒鸡尾酒中的两种能够在杆中专门打开绿色荧光蛋白的生产,而第三病毒鸡尾酒靶标棒,锥体等视网膜细胞;然而,只有每种病毒载体的适当浓度被证明是正确的。当病毒滴度为1011 vg/ml时,使用mOP和hGRK1启动子都可以实现高效和特异的杆状转导,并保存视网膜结构。
“现在我们已经证明了这种类型的送货可以完成,”宾夕法尼亚兽医学院的眼科助理教授威廉A.Beltran表示,下一步是使用犬瞄准普通杆退化模拟人类疾病的模型。交付a病毒载体,与杆状特异性启动子相结合可能是最安全,最有效的方法,可以纠正疾病,如X-Conted和常染色体显性视网膜炎,这两者都导致完全失明。“
一种被称为RPE65-Leber's先天性黑内障(LCA)的儿童失明形式,是第一种也是迄今唯一一种可以矫正的遗传性视网膜疾病基因治疗目前正在三项临床试验中进行测试。在其在人类患者中使用前参加本研究的一些科学家首次在狗中发达并完善了这种治疗。
这项研究发表在最新一期的《科学》杂志上基因治疗。
进一步探索









用户评论