癌症导致细菌靶向肿瘤抑制蛋白
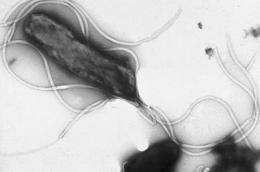
研究人员发现了一种机制幽门螺杆菌,唯一已知的癌症细菌禁用宿主细胞中的肿瘤抑制蛋白。
新研究,在期刊中oncogene.,报告先前未知机制的发现H. Pylori.感染和胃癌,全球癌症死亡的第二个主要原因。
大约三分之二的世界人口被H. Pylori感染,一种可以在胃的恶劣环境中存活的细菌。大多数受感染者从不发展疾病。然而,对于少数群体,感染H. Pylori.导致炎症,溃疡和某些情况下,胃(胃)癌症。
H. Pylori.引起疾病的能力与称为Caga的毒力蛋白质密切相关。以前的研究发现,CAGA阳性菌株更容易引起炎症并促使导致癌症的细胞分裂的异常细胞分裂和生长。
H. Pylori.将Caga注射到胃线的上皮细胞中。在细胞内,Caga能够劫持各种信令途径并破坏正确的信号蜂窝功能。
其他研究已经确定了Runx3(明显的跑步-3)作为一个重要胃癌肿瘤抑制剂。
伊利诺伊州医学生物化学大学林金森大学林金森大学,林枫·陈大学,林峰·陈大学,林峰·陈教授的发展丧失是因果关系。Runx3通过刺激针对靶向不健康的细胞破坏的因素来防止肿瘤形成。
“虽然出现的证据表明,Runx3是一种肿瘤抑制剂,其灭活参与胃癌的开始和进展,”作者写道,“胃细胞内的Runx3失活的触发很大程度上是未知的。”
“蛋白质,Runx3是转录因子,因此它激活了控制细胞生长和死亡的不同类型的基因,”陈说。“我们想要看到的第一件事是吗?H. Pylori.对Runx3的转录活动有任何影响。“
陈的实验室的两位研究生Ying-Hung Nicole Tsang和Acacia Lamb,通过检查Runx3转录活动开始研究H. Pylori.- 活化的胃上皮细胞。他们发现用Caga阳性感染H. Pylori.抑制RUNX3的转录活性和细胞中runx3蛋白的降低水平。
Caga-Daly.H. Pylori.对Runx3级别或活动没有影响。
“事实上,只有传奇人才足以下调润X3转录活性并减少RUNX3的表达,进一步支持这种细菌蛋白在胃病的成因中的重要性,”陈说。
进一步的测试表明,Caga和Runx3在人上皮细胞中彼此身体相互作用。研究人员发现,CAGA中的新识别的域,WW域,识别RUNX3蛋白中称为“PY主题”的序列。他们进一步表明,该相互作用导致RUNX3的“标记”通过称为泛素化的过程来降解。
以前的研究发现,存在有几个独特的序列
Caga的羧基末端区域对蛋白质与宿主蛋白相互作用并破坏正常细胞过程的能力至关重要。
“这是任何人第一次确定内部的唯一域名
Caga蛋白的氨基末端区域,它将有助于我们更好地了解这种致癌蛋白质的功能,“陈说。”这项研究发现了在启动中的新一步H. Pylori.诱导的胃癌。“
细胞中许多有害变化的积累导致癌症的发展。runx3帮助细胞在蜂窝过程开始时反应,所以H. Pylori.陈说,诱导runx3的降解“可以产生抑制异常细胞变化的条件。”
陈的小组正在努力确定CAGA目标Runx3进行降解的分子机制。他和他的同事希望设计可以专门抑制RUNX3和CAGA之间的相互作用的小分子,并阻止RUNX3的降级。这些药物可用于预防胃肠诱导的胃疾病H. Pylori.。
进一步探索












用户评论