新的研究说明癌细胞“吃我们的生命”
四个关键研究提出一个新的理论如何癌细胞的生长和生存,允许研究人员设计更好的诊断和治疗目标高风险的癌症患者。这些研究是由一个大型研究团队的托马斯杰斐逊大学Kimmel癌症中心。
这个新的想法也解释了为什么很多癌症病人说“他们的癌症是吃活着”——从未被理解的准确观察,研究人员说。
这四个新研究,共同发表在九月份的《华尔街日报》细胞周期提供证据,肿瘤的生长和转移是直接“推动”,支持细胞正常。
这些支持细胞被称为成纤维细胞,产生基质(结缔组织),肿瘤细胞。随着癌症的发展,越来越多的这些基质细胞吃自己为肿瘤细胞提供营养回收,导致戏剧性的减肥的患者。
他们还发现,没有再生营养物质提供的成纤维细胞,肿瘤细胞更加脆弱而死。在此基础上突破,研究人员提出,可用药物(现在市面上),切断了“寄生”肿瘤细胞和成纤维细胞之间的联系,可能是有效的治疗。
“我们认为我们终于发现癌症真的是如何工作的——这改变85年的教条,基于目前的癌症研究和治疗,”这项研究的高级研究员说,迈克尔·p·Lisanti医学博士博士,主席杰佛逊的干细胞生物学和再生医学。
盛行的理论,称为Warburg效应,1924年由德国研究员奥托华宝(他获得诺贝尔奖),说,肿瘤细胞改变他们的新陈代谢以推动自己的增长。作为证据,华宝指出缺乏线粒体,微小的“发电厂”在实验室癌细胞,说这些细胞发现了另一种生产他们所需要的能量。
理查德•Pestell MB, BS,医学博士,博士,FRACP, Kimmel癌症中心主任和合作者在这些研究指出,“这些研究表明,缺乏线粒体在实验室癌细胞可能反映了在一定程度上培养细胞必须调整原有以外的生活环境,没有他们的基质的合作伙伴。“Drs。Lisanti, Pestell和他的同事们发现通过执行一个简单的实验,他们癌症细胞和成纤维细胞混合在一起,然后寻找线粒体。发现成纤维细胞没有线粒体,而癌细胞线粒体。
“Warburg效应发生,但发生的成纤维细胞,肿瘤细胞。成纤维细胞没有线粒体,因为他们吃他们为肿瘤细胞提供能量,和癌症细胞有大量的线粒体,因为他们需要这些发电厂处理所有纤维母细胞的再生营养给他们,然后帮助他们成长和传播,“Lisanti博士说。
他们称这一发现“反向Warburg效应”。
“这是惊人的,”Lisanti博士说。“我们知道癌症是向后,因为癌症研究人员使用孤立的肿瘤细胞对大多数癌症研究。现在,当我们把癌症细胞在基质环境,我们看到癌症细胞极度依赖成纤维细胞生存。”
肿瘤细胞通过采用氧化应激作为武器。然后,氧化应激在成纤维细胞“技巧”这些基质细胞吃饲料癌细胞,研究人员说。这个“自食”或“self-cannibalism”的过程被称为自噬。
在饥荒时期,正常细胞发生自噬。这种代谢重构允许细胞回收养分通过不断吃自己,包括它们的线粒体。这允许饥饿细胞回收养分和敌意的条件下生存。
现在,Lisanti博士和他的同事们已经找到了癌症细胞如何利用这一循环过程。来满足他们的大胃口,饥饿的癌细胞诱导成纤维细胞氧化应激和这个压力迫使基质细胞吃自己,提供回收养分或“食物”燃料附近的癌细胞的生存。
“就这么简单。肿瘤细胞从正常细胞被偷吃我们的生命养分利用氧化应激,并利用这些回收营养支持自己的经济增长。从骨髓干细胞然后招募生产新鲜的成纤维细胞,不断推动癌症细胞增长,”Lisanti博士说。“多年以来,癌症患者说,他们觉得他们身体的癌症是吃他们的生命。这些病人是正确的。从本质上说,癌症知道如何诱导氧化应激,当地一个浪费的过程变成一个全身现象”。
合著者Ubaldo Martinez-Outschoorn,医学博士医学肿瘤学家杰佛逊说,“病人已经告诉我们癌症是吃活多年:现在我们知道他们是对的!”他的一位癌症患者最近说,“医生,我不能吃足够的食物来保持我的体重。无论我吃多少,我觉得累,我总是减肥。”
“现在我们理解机制,这改变我们思考癌症新陈代谢和关于如何阻止这种压力和饿死癌细胞,”他说。
Lisanti博士发表的研究表明,使用抗氧化剂可以防止成纤维细胞的氧化应激,从而切断燃料供应癌细胞,饥饿。“我们现在进行药物筛选化验发现新的抗氧化剂和其他分子,”他说。
研究人员另外确定两个关键代谢物-酮和乳酸-选择产生的成纤维细胞,提供高能量食物癌细胞。这一发现也解释了一个谜,并提供一个警告。
神秘的问题为什么糖尿病患者比非糖尿病更有可能患上癌症。Lisanti博士说,原因是,糖尿病患者产生的酮水平升高,而他现在显示酮燃料癌细胞的生长。
的警告来自乳酸的共同使用,一种糖,在癌症患者。外科医生经常给他们的癌症患者静脉乳酸溶液,在手术之后,Lisanti博士说。”,但我们发现癌细胞是使用能源燃料,如乳酸、线粒体数量增加的癌症细胞生长,生存,和转移,所以外科医生可能要重新考虑或停止这一做法。”
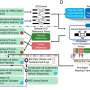
这个发现让研究人员问题的价值研究使用实验室癌细胞,大多数癌症研究的基础上,由于它的抗癌药物。
例如,基因突变一直被认为是癌症的根源,但Lisanti博士的小组观察到这些变化可能与肿瘤细胞的相互作用的结果正常基质。癌症细胞氧化应激诱导的成纤维细胞反馈在癌细胞,放大生产活性氧(ROS)。他们相信ROS然后用自己癌细胞突变基因促进生存。
“这些活性氧分子导致肿瘤细胞DNA损伤,导致基因组不稳定性——随机突变和DNA断裂,以及染色体数目异常。这种不稳定有助于肿瘤细胞演变成一个更激进的形式,“Lisanti博士说。
“所以,我们看到三个后果造成激活氧化应激在正常基质细胞,”他说。“首先,它迫使基质细胞癌细胞的食物。其次,丰富的食物可以防止癌细胞死亡。最后,氧化应激修改癌细胞DNA,引起基因突变,并允许他们发展成一个更激进的形式。”
此外,研究人员说他们的新基质代谢重构理论表明,癌细胞不需要血管给他们,这就解释了为什么有些angiogensis抑制剂(关闭血管生长的药物)并没有成功,事实上,可能是危险的。
“如果一个咄咄逼人的癌细胞可以使用从正常提取营养基质细胞氧化应激,它可以去任何地方而不需要血液供应。这可能是癌症细胞如何遍布身体,“Lisanti博士说。“此外,血管生成
抑制剂引起缺氧,低氧,在基质。这正是通过自噬驱动养分循环的条件。因此血管生成抑制剂可能帮助提供食物或回收营养饲料癌细胞。这就解释了为什么血管生成抑制剂在临床试验中已经非常令人失望,因为他们可能是刚刚相反的效果,促进癌细胞的生长和转移。”
这些新的发现也为癌症诊断有明显的影响,研究人员说。Lisanti博士的研究小组发现许多分子可以作为诊断识别高风险的癌症患者或监控他们的抗癌治疗的成功。
其中caveolin-1 (Cav-1),这是由成纤维细胞产生的。早些时候,Lisanti博士就表明Cav-1损失预测乳腺癌患者预后不良,与早期的肿瘤复发,转移和耐药。他现在明白为什么乳腺癌患者基质Cav-1喂养他们的缺席癌症细胞通过回收养分。这就解释了为什么基质Cav-1的丧失是一个很好的生物标志物识别高危病人。
“癌细胞的当地环境对肿瘤的生长很重要现在广为接受的癌症研究社区,“Lisanti博士说。“现在我们展示为什么这个观点是正确的。”
这些研究的资助来自美国国立卫生研究院国家癌症研究所,苏珊·g·科曼的治愈,美国癌症协会,乳腺癌联盟,福尔克医学研究信任,Landenberger研究基金会和宾西法尼亚州卫生部门。ob欧宝直播nba