与葛雷克氏症相关的故障基因会导致老鼠神经细胞死亡
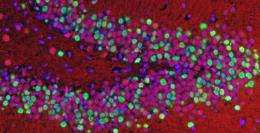
(physorg.com) - Lou Gehrig的疾病,或肌萎缩的外侧硬化症(Als)和额定血瓣退化(FTLD)的特征在于脑和脊髓细胞中的蛋白质丛,包括称为TDP-43的RNA结合蛋白。该蛋白质是由这些丛形成的病变的主要构建块。
一项研究发表在临床调查杂志是由弗吉尼亚M.-领导的团队。Lee,Phd,Penn的神经退行性疾病研究中心主任描述了第一种直接证据,即突变的TDP-43如何导致神经元死亡。虽然通常在调节基因表达的核中发现,TDP-43是在2006年首次发现的,由Lee和John Q. Trojanowski,MD,博士,博士,博士,博士,博士,博士学位,TDP-43首次被发现为ALS和FTLD中的主要疾病蛋白。钢笔老龄化研究所。这次发现通过将它们与同一疾病蛋白质链接来转变对ALS和FTLD的研究。
“将TDP-43发现为ALS和FTLD中神经系统变性机制之间的病理联系,为这些疾病的药物发现以及生物标志物发育的新机会开辟了新的机会,”Lee说。“类似于ALS和FTLD的TDP-43介导的疾病的动物模型将加速这些努力。”
在TDP-43的情况下,神经元可能死于两个原因:一个,丛本身对神经元有毒,或者,当TDP-43在细胞核外的丛中束缚时,它耗尽通常运作的TDP的细胞43。通常,细胞在本身调节TDP-43的确切量 - 太多了,太糟糕了也很糟糕。TDP-43功能的丧失在调节疾病方面是重要的,因为它调节基因表达。
为了确定错位TDP-43对神经元的活力的影响,研究人员在细胞质中表达了人类突变的TDP-43的转基因小鼠,并将其与在神经细胞核中表达正常人体TDP-43的小鼠。人类TDP-43的表达导致脆弱的前脑区中的神经元损失;部分的退化脊髓道路;老鼠中的肌肉痉挛。这些效应重新承载FTLD的关键方面和称为原发性侧刀中的ALS的亚型。
JCI的研究表明,功能的急剧丧失会导致神经细胞死亡,因为当人类突变的TDP-43基因放入小鼠体内时,正常小鼠的TDP-43被消除。由于细胞可以调节TDP-43的确切数量,人类TDP-43蛋白的过表达会阻止小鼠TDP-43的正常功能。Lee和他的同事认为,这种效应导致神经元死亡而不是TDP-43的聚集,因为在这项研究中观察到的小鼠细胞中,这些聚集非常罕见。Lee说,目前还不清楚为什么这种小鼠模型中很少出现结块,而这种结块在肌萎缩侧索硬化症和FTLD患者死亡后的脑组织中非常普遍。
表达TDP-43的小鼠神经元——包括正常的和突变的人类版本——的神经变性伴随着小鼠生来就具有的TDP-43蛋白的显著下调。更重要的是,表达突变的人类TDP-43的小鼠在神经细胞的基因表达上表现出了深刻的变化脑的皮质。
结果表明,扰乱细胞核中的正常TDP-43导致损失正常的TDP-43功能和基因调节途径,最终导致受影响神经元的变性。
研究人员说,下一步将是寻找受TDP-43调控的特定基因,以及mRNA剪接是如何参与其中的,从而纠正这些基因的异常调控。
与此同时,Lee指出:“我们将很快启动新的策略研究,以防止tdp -43介导的神经系统退化,使用这种ALS和FTLD小鼠模型。”







用户评论