解开朊病毒蛋白是如何沿着大脑轴突运动的
加州大学圣地亚哥分校医学院的研究人员已经确定了在许多哺乳动物细胞中发现的非传染性朊病毒蛋白(PrPC)在长长的神经元运输路径上上下移动的马达。确定PrPC的正常运动机制可能有助于研究人员了解传染性朊病毒在神经元内部和神经元之间到达大脑的传播,并有助于开发阻止这种运输的治疗方法。
他们的研究发表在2月18日的杂志上细胞.
小朊蛋白存在于大脑神经元的细胞膜中。这种蛋白质的错误折叠或传染形式(也称为“痒病”)是导致“疯牛病”的原因,也与人类的克雅氏病有关。非传染性和痒病相互作用产生疾病;因此,为了帮助揭示感染是如何在神经元细胞内部和神经元细胞之间传播到大脑的,加州大学圣地亚哥分校的科学家们研究了小鼠神经元细胞中正常PrPC的运动机制。
“我们解开这种朊病毒蛋白正常运动机制的工作将帮助我们了解在疯牛病和其他朊病毒疾病中发现的毁灭性致病性版本是如何形成和传播的大脑.有趣的是,我们的工作也可能揭示其他神经退行性疾病(如阿尔茨海默病)的问题,”首席研究员拉里·戈尔茨坦博士说,他是细胞和分子医学教授,霍华德·休斯医学研究所研究员和加州大学圣地亚哥分校干细胞项目主任。
众所周知,正常的朊病毒蛋白和传染性的朊病毒需要相互作用才能使朊病毒发病,但不知道这些相互作用是如何或为什么发生的。发现朊病毒的转运机制是解开这两种蛋白质相互作用之谜的关键之一,而转运调节中的一个重要问题是如何控制细胞中的运动活动。
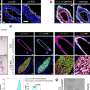
朊病毒蛋白货物沿着长长的微管轨道沿着外周和中枢神经系统神经向末端或突触移动,在膜结合的囊泡中。细胞内的运输通常是双向的,因为货物在到达最终目的地的途中会定期改变航线。
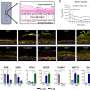
研究人员发现驱动这些囊泡的马达是顺行型的驱动蛋白-1(只向突触移动)和逆行型的动力蛋白(远离突触)。这两个马达蛋白在PrPC囊泡上组装,沿着微管来回“行走”。
其次,他们发现货物来回移动是由调节因素调节的,而不是由汽车-货物联系的任何结构变化。研究数据表明,Kinesin-1和dynein的活性紧密耦合,PrPC囊泡沿轴突以不同的速度和不同的长度运动。然而,这些马达组件的类型和数量仍然稳定地与静止的和移动的囊泡相关,并且由Kinesin-1的正常逆行运输独立于动力蛋白-囊泡附着。
UCSD研究了正常囊泡运动背后的机制轴突对小鼠细胞的研究也可能为其他神经退行性疾病提供线索。虽然阿尔茨海默病通常不被认为是一种像疯牛病一样的传染病,但新出现的数据表明,Tau蛋白、β淀粉样蛋白和α -突触核蛋白(与阿尔茨海默病和帕金森病有关的蛋白质)具有具有朊病毒特征的自我繁殖纤维结构。
UCSD细胞和分子医学系的第一作者Sandra E. Encalada博士说:“这些有毒分子是否以类似于正常朊病毒蛋白的方式沿着神经元运输途径传播尚不清楚。”“但是,对这些正常机制的描述可能会导致一种控制细胞内聚集物运动的方法,也可能是治疗许多神经退行性疾病的方法。”