对葛雷克氏症突变蛋白的研究揭示了药物发现的新途径
有几个基因与肌萎缩性侧索硬化症有关,最近的一个基因被称为FUS。两项新的研究公共科学图书馆生物学一项来自宾夕法尼亚大学医学院(University of Pennsylvania School of Medicine),另一项来自布兰代斯大学(Brandeis University)的同事,他们都对酵母中FUS的生物学特性进行了研究,发现RNA生物学的缺陷可能是FUS如何导致肌萎缩性脊髓侧索硬化症(ALS,又称卢·格里格氏症)的关键。这些发现为开发药物指明了新目标。
蛋白质在大脑中聚集形成不可溶的结块脊髓ALS患者。在一些ALS病例中,凝结蛋白是FUS,而在另一些病例中,它是另一种叫做TDP-43的蛋白质。FUS和TDP-43都是具有相似特征的rna结合蛋白。例如,这两种蛋白质都包含一个区域,该区域与使某些蛋白质在酵母中形成朊病毒的部分类型非常相似。朊病毒是一种会引起疯牛病和人类的克雅氏病尽管有这些相似之处,但尚不清楚TDP-43和FUS是否都以相似或不同的方式导致ALS。
2009年,两组研究人员在一些肌萎缩性侧索硬化症患者中发现了FUS基因突变。同年,细胞与发育生物学助理教授、资深合著者亚伦·吉特勒(Aaron Gitler)博士使用酵母模型研究FUS,并确定这些突变对其功能的影响。与此同时,该研究的共同高级作者、生物化学和生物物理学助理教授詹姆斯·肖特(James short)博士对FUS蛋白进行了纯化,并研究了使其容易形成结块的特性。Gitler和Shorter之前曾合作研究过酵母细胞中的TDP-43和纯蛋白分析。“这是一个激动人心的时刻。对于渐冻症的分子分子来说,这幅图景正在形成。”
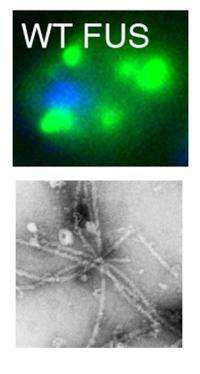
当研究人员在酵母中过度表达人体FUS时,在酵母细胞的细胞质中形成的团块。TDP-43也在酵母细胞中形成丛。“然而,在酵母细胞和纯蛋白质测定中融化的方式存在重要差异,”纯蛋白质分析“,”Gitler Lab Prodoctoral Som和Co-First Author Sun,Phd。
FUS通常存在于人类细胞的细胞核中。在一些与als相关的FUS突变中,该蛋白在细胞质中更为丰富,这表明可能正是这种错位导致了疾病。与此相一致的是,两组研究人员都发现,将正常FUS蛋白过表达限制在细胞核内可以减少结块。两组均显示FUS和TDP-43促进结块的生化特征不同。
“类似朊病毒的部分对两种蛋白质的凝结都非常重要,但令人惊讶的是,与TDP-43相比,FUS需要蛋白质单独部分的额外序列来启动凝结,”Shorter说。short实验室研究专家、共同第一作者Zamia Diaz解释说:“这表明,与TDP-43凝块相关的肌萎缩侧索硬化的发病机制可能不同。”
“老实说,我们预计TDP-43和FUS在酵母中以及纯蛋白质水平上的蛋白质如何结块的行为是相同的。接下来我们问什么蛋白质可以逆转毒性?TDP-43逆转剂是否影响FUS的结块毒性?
“我们很惊讶他们竟然不一样,”肖特说。
在FUS的屏幕上,他们发现基因与细胞结构有关的应激颗粒可以拯救酵母细胞内fus相关的毒性。这些颗粒在细胞受到压力时(如温度升高、毒素暴露或损伤)将rna隔离,以便在压力过去后使用,因为细胞需要储存能量。rna用于将遗传密码翻译成蛋白质,这将消耗细胞的大部分能量。FUS的突变似乎促进其被隔离在应激颗粒中,FUS毒性与这些颗粒有关。这些结构是否在FUS毒性中起直接作用尚不清楚。但两组的新研究表明,它们确实在FUS毒性中发挥了关键作用。他们使用全基因组筛选来寻找能够逆转FUS毒性的基因。
“在全基因组筛选中,我们对FUS毒性与TDP-43毒性的基因缺乏重叠感到惊讶酵母细胞说,“短。
迪亚兹补充说:“这意味着我们需要针对不同的途径,即fus相关肌萎缩性侧索硬化症和tdp -43相关肌萎缩性侧索硬化症的蛋白质。”
这些研究为一些肌萎缩性侧索硬化症病例的新疗法指明了道路,这些疗法是基于RNA处理的。他们还建议谨慎看待TDP-43和FUS都以同样的方式导致ALS的假设。在酵母中测试致病机理和治疗的想法更快、更便宜,这导致了对这种疾病和最终治疗方法的更快了解。
吉特勒总结道:“我们能从酵母中了解到的东西确实令人惊讶。”
进一步探索













用户评论