斑马鱼模型中神经纤维导航纠正失败,提示药物治疗的可能性
脊髓性肌萎缩症(SMA)是2岁以下儿童死亡的主要遗传原因,除支持性护理外无其他治疗。在美国国家科学院院刊波士顿儿童医院(Children’s Hospital Boston)的研究人员展示了SMA基因缺失或突变如何导致进行性肌肉退化和肌无力,并提出了一种很有前途的治疗方法。这种疾病有时被称为“婴儿卢·格里格氏症”(Lou Gehrig's disease of babies)。
根据脊髓性肌肉萎缩症基金会(SMA Foundation)的数据,每6000 - 10000名婴儿中就有1人患有脊髓性肌肉萎缩症,但据估计每35-40人中就有1人是携带者。患有SMA的婴儿出生时肌张力低下,在许多情况下太弱而不能自主呼吸和吞咽;他们通常死于呼吸衰竭。
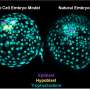
新的发现揭示了SMA基因的缺失——以及由此导致的一种叫做SMN的蛋白质的缺失——使得神经纤维从神经纤维中分离出来脊髓无法导航到它们应该控制的肌肉并与之形成突触(连接)。但他们也证明,这个问题可以在斑马鱼的疾病模型中逆转。
为了弄清楚SMN蛋白的功能,由儿童F.M. Kirby神经生物学中心的Mustafa Sahin医学博士和Judith Steen博士领导的研究人员开始研究SMN与什么相互作用。他们使用了蛋白质组学中的质谱技术来研究SMN会结合哪些蛋白质。
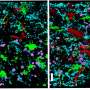
其中一种名为HuD的蛋白质大获成功。研究小组还发现,SMN和HuD同时存在于运动神经元分支的神经纤维(轴突)中,而且它们都与调控另一种蛋白质neurittin(也称为cpg15)产生的rna结合。
随后,沙欣与俄亥俄州立大学的克里斯汀·贝蒂博士合作,后者开发了这种疾病的斑马鱼模型。当SMN蛋白在斑马鱼胚胎中受阻时,轴突明显异常。沙欣说:“它们的分支方向是错误的,并没有真正到达正确的肌肉。”“我们认为这可能是神经鞘素丢失造成的,于是问,‘我们能否恢复神经鞘素,使轴突恢复正常?’”
当他们通过向斑马鱼胚胎中注入神经鞘RNA人为刺激神经鞘素的产生时,轴突从脊髓正常分支并与肌肉正常连接。
沙欣指出,神经鞘素分泌在神经元外,这意味着它可能作用于表面受体。这使得神经鞘素或类似作用的化合物成为药物治疗的良好候选者。下一步是寻找神经鞘素受体和刺激神经鞘素的药物,包括神经鞘素自身的修饰形式或片段。在即将进行的实验中,沙欣的团队将转向小鼠,尝试不同的方式传递神经鞘素或相关化合物,然后看看肌肉力量和存活是否得到改善。
目前SMA领域的研究主要集中在制造更多耗尽的SMN蛋白本身。沙欣说,对于培养皿中的细胞来说,这相对容易实现,但要将SMN人工引入脊髓内的运动神经元中发挥作用就很难了。在小鼠模型中,SMN的增加似乎增加了肌肉力量,小鼠活得更长。但在人体临床试验中,这种方法尚未产生积极的结果。
神经鞘素的发现暗示了另一种可能更直接的方式来做同样的事情;也许这将扩大治疗的机会。沙欣说:“SMA目前是一种毁灭性的疾病。”“没有治愈的办法。到目前为止,我们只能控制症状,防止并发症。”
进一步探索






用户评论