美国专家组拒绝使用阿瓦斯丁治疗乳腺癌
周三,一个专家小组敦促美国食品和药物管理局取消罗氏公司生产的用于治疗乳腺癌的药物阿瓦斯汀的标签,因为它既不安全也不有效。
在瑞士制药巨头的美国子公司Genentech罕见地举行了为期两天的上诉听证会后,专家组以6票赞成、0票反对的结果,支持其去年12月提出的停止使用阿瓦斯丁治疗乳腺癌的建议。
该小组说,这种药物也被称为贝伐单抗,有严重高血压和出血等风险,并不能延长乳腺癌患者的总体生存期。
FDA专员必须做出最终决定,但不太可能在7月底之前做出。FDA不必遵循专家小组的建议,但它通常会这样做。
审判将持续到7月28日征求公众意见,随后将做出最终决定,但具体日期尚未宣布。
FDA表示:“专员有关乳腺癌的决定不会影响Avastin用于结肠癌、肺癌、肾癌和脑癌的批准适应症。”
“也就是说,无论转移性乳腺癌的最终审批结果如何,Avastin都将继续在市场上销售。”
据媒体报道,一些公众聚集在举行听证会的FDA大楼外,其中包括身穿粉红色衣服、举着“我不仅仅是一个统计数字”的标语的女性。
服用阿瓦斯丁的乳腺癌患者被允许谈论他们的经历。
之后,自由获取药物(FAMEDS)的创始人特里·卡利(Terry Kalley)说,他对这个决定感到失望,但并不惊讶。
“这个对乳腺癌生死攸关的问题做出裁决的小组本应由乳腺癌专家和肿瘤专家组成,但它却没有任何乳腺癌专家和肿瘤专家,”Kalley在裁决后的周三的新闻发布会上说。
“昨天有乳腺癌肿瘤学家代表我们作证,让患者能够使用阿瓦斯丁。”
根据声明,凯利的妻子患有晚期乳腺癌,“在阿瓦斯汀的极大帮助下”。
然而,FDA专家组认为,支持该药物的论据不足以动摇专家组早先的决定。
FDA表示,最初的试验结果显示,患者有额外5个月的“无进展生存期”,这一结果无法重复,而且一些死亡与该药有关。
“听证会也为公众提供了一个机会来观察和参与FDA每天考虑药品批准或撤回批准的艰难决策过程,”Karen Midthun说,生物制品评价与研究中心主任主持了听证会。
“正如听证会开始时的公开陈述所表明的那样,FDA的重点始终是我们的决定将对使用这些产品的患者产生的影响,包括那些可能受益于这些产品的患者,以及那些也可能受到这些产品伤害的患者。”
Genentech表示,在FDA做出最终决定之前,该药仍将被批准与化疗药物紫杉醇联合用于转移性her2阴性乳腺癌的一线治疗。
基因泰克首席医疗官兼全球产品开发主管哈尔·巴伦(Hal Barron)表示:“我们对委员会的建议感到非常失望,希望专员不会决定移除这种对患有不治疾病、且治疗选择已经太少的女性来说很重要的药物。”
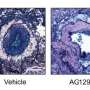
阿瓦斯丁的目的是防止新血管到达肿瘤,并为肿瘤提供生长所需的营养物质。在第一个临床试验中,当与泰索帝联合使用时,该药物抑制了癌症的进展并增加了患者的生存期。
Barron补充说:“我们仍准备与FDA合作,寻找符合需要Avastin患者最佳利益的解决方案。”
根据媒体引用的数据,如果阿瓦斯丁被从乳腺癌治疗市场上撤下,罗氏每年将损失10亿美元的收入。
欧洲医学专家呼吁限制该药只能与紫杉醇联合使用,而不能与其他形式的化疗药物联合使用,因为疗效尚不确定。
进一步探索
(c) 2011法新社









用户评论