研究证明了新基因载体的潜力,以扩大眼病治疗
通过使用基因治疗纠正遗传类型的失明,来自宾夕法尼亚大学的佩尔布尔曼医学院的调查人员的灵感来自于宾夕法尼亚大学的遗传学患者,旨在扩展其对其他类型的眩目障碍的方法。
在以前在费城和宾恩儿童医院进行的人类审判中,研究人员包装了莱伯的先天性生物症(LCA)在遗传工程载体中缺失的正常版本,称为腺相关病毒(AAV)。载体将基因递送给细胞中视网膜,该基因产生恢复轻受体的酶。
“LCA的三阶段I临床试验的结果表明基于腺相关病毒的基因治疗潜力基因to the retina," notes co-senior author Jean Bennett, MD, PhD, the F.M. Kirby professor of Ophthalmology. "To broaden treating inherited eye diseases, we will need a larger vector toolkit, and what we have seen of AAV8 gives us hope for creating gene therapies for diseases that attack the retina's photoreceptors. This preclinical study provides the guidance we need to formulate dose level and type of vector to deliver corrective genes to treat blindness caused by the loss of photoreceptors."
在本研究中,发表在科学翻译医学本周,宾馆团队比较了两种不同类型AAVS - AAV2的动物模型的安全性和效率,用于LCA的人类试验和AAV8,最初在实验室中发现的第二代AAV技术Co-Sear Author James M. Wilson,MD,博士,病理学和实验室医学教授。
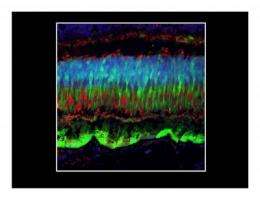
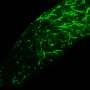
研究人员使用了两个向量来交付绿色荧光蛋白(GFP)转基因视网膜颜料非人印象的上皮(RPE)细胞和光感受细胞。感光体细胞是其他视网膜疾病的问题区域,如视网膜炎Pigmentosa.(rp)和其他,没有治疗。光感受器是专门的神经细胞,其将光转换为生物电信号,并指定为杆和锥体。
“我们展示我们可以使用AAV8将基因递给较低剂量,安全有效地将基因传递给灵长类动物的感光体,”基因治疗计划第一作者Luk H. Vandenberghe,博士学位,目前在Penn的F.M.柯比分子眼科中心。
AAV2和AAV8都安全有效地向猴子视网膜提供了基因,但AAV8在瞄准时明显更好感光体细胞。
STM研究描述了AAV2和AAV8载体与其靶细胞之间的剂量关系以及非人类灵长类动物视网膜中的免疫应答。从该研究人员发现剂量阈值,以安全有效地靶向外视网膜中的细胞,例如RPE细胞和杆和锥形光感受器。虽然AAV2和AAV8有效地将基因交付给RPE细胞在中等至低剂量时,仅在更高剂量下达到杆和锥形光感受器中GFP基因的表达。用中等剂量的AAV8获得对棒的大量输送,类似于实验性临床方案中使用的剂量。
中间剂量的载体不会引起问题的免疫应答和手术后注射复杂性。递送的基因在整个研究持续时间为4个月的过程中,在视网膜中也保持在视网膜。另外,优先转导GFP基因对一类视网膜神经节细胞,这让研究人员感到惊讶。在一般视网膜神经节细胞将视觉信息从视网膜发送到大脑的几个区域。该知识可以在将来使用,进一步描绘视网膜和大脑之间的神经元连接。
在早期的动物研究中,AAV8还可以安全有效地向小鼠视网膜提供基因。然而,小鼠视网膜与灵长类动物视网膜有显着不同,最值得注意的是结构,这会影响将矫形基因递送到眼睛不同部位的手术方法。(例如,小鼠没有MACULA - 用于视觉鉴别的眼睛结构,其在黄斑变性 - 和灵长类动物中受到影响 - 和灵长类动物。)非人类灵长类动物的目前研究是更好地翻译人员治疗策略的下一步。
“为了解决其他视网膜疾病的患者,我们需要一个新的技术文艺复兴 - 新的和更好的载体,安全有效地向一系列疾病提供矫正基因,”威尔逊说。“我的实验室最近孤立了基于昔日的腺病毒和腺相关病毒的新家庭。这些病毒的重组版本正在转出作为改进的基因转移车辆到各种目标。”
进一步探索







用户评论