干细胞模型为继承的ALS提供了线索
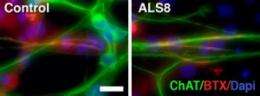
由加利福尼亚大学的研究人员领导的国际科学家队伍,圣地亚哥医学院使用诱导的多能干细胞(IPSCS)衍生自肌营养的侧面硬化(ALS)患者首次揭示特定的水平减少蛋白质可能在导致至少一种遗传形式的疾病中起着核心作用。
工作,发表于2011年6月在线问题的期刊人类分子遗传学,可以帮助科学家克服研究和治疗ALS的主要障碍,这是一种无法治愈的神经肌肉病症也称为lou gehrig的疾病。ALS普遍致命,中位年龄为55岁,症状出现后两至五年的生存。过去的研究努力长期以来一直在转化ALS动物模型中的成功药物测试的困难。
“迫切需要ALS人类模型,可以转化为临床试验,以验证人类的治疗目标遗传背景,“UCSD儿科和分子医学联合国组织和分子医学部门的助理教授Alysson R. Muotri,博士学位,以及该研究的高级作者之一。”啮齿动物已经过去使用,并ob体育开户网址且仍然对揭幕性的影响仍然存在危险影响als,但绝大多数药物在啮齿动物模型中表现出诊断的疗效在临床前和临床人类试验中没有相同。“
在新的工作中,Muotri和同事转向IPSCs来自的IPSC皮肤细胞患有家族形式的ALS叫做ALS8的患者创造运动神经元这提供了一种新型的疾病模型。从ALS患者的IPSC之前已经描述过,但发现细胞和分子表型证明是一个持续的挑战。由于在运动神经元分化期间可以跟踪突变的基因,因此使用ALS的家族形式提供了优势。
“我们不知道是什么原因导致大多数ALS病例,但对于大约10%的ALS患者,疾病是遗传遗传突变的结果,”Muotri说。“这些家族形式之一是ALS8,其来自VAPB基因中的突变。使用来自两个独立家庭的几名患者的IPSC,我们发现与来自非载体的类似细胞相比,AlS8衍生的运动神经元中的VAPB蛋白水平降低ALS8患者的兄弟姐妹。“
Muotri表示,该发现表明VAPB蛋白质水平降低可能是ALS8发育的关键,也许其他形式的疾病,包括零星或非遗传性ALS,其中减少了VAPB蛋白质水平还被记录下来。
“VAPB蛋白涉及许多细胞过程,因此它似乎有助于其他形式的ALS的发病机制,”Muotri说。“我们尚不知道VAPB的损失是如何涉及造成家族或孢子的血液,但研究人类细胞中这种疾病的新能力提供了一个前所未有的回答该问题的机会,开发新的早期诊断工具和识别未来药物和疗法的新目标。“
进一步探索








用户评论