研究发现酶破坏神经细胞交流在阿尔茨海默氏症
阿尔茨海默病的特点是异常蛋白质在有点儿粘在一起,破坏认知功能(思维、学习和记忆)。这些粘蛋白主要是由β-淀粉样蛋白肽。更好的理解这些蛋白质,它们如何形成,以及它们是如何影响大脑功能无疑会提高阿尔茨海默病的诊断和治疗。
为此,斯图亚特·a·利普顿领导的研究小组,医学博士博士在孚-伯纳姆医药研究所(Sanford-Burnhob欧宝直播nbaam)发现beta-amyloid-induced破坏神经细胞之间的突触(连接调解沟通由一种叫做Cdk5的酶的化学修饰。研究小组发现,这种改变的Cdk5形式(SNO-Cdk5)是普遍的人类阿尔茨海默病的大脑,而不是正常的大脑。这些结果,网上公布的8月15日美国国家科学院院刊》上美国的,表明SNO-Cdk5可以针对新的阿尔茨海默病治疗的发展。
Cdk5是一种酶发挥作用在正常神经元存活和迁移。在这项研究中,立顿博士和他的同事们发现,β-淀粉样蛋白肽阿尔茨海默病的标志,引发化学过程被称为S-nitrosylation Cdk5修改。在这个反应中,一氧化氮(NO)与酶,生产SNO-Cdk5和扰乱其正常活动。
“没有附加Cdk5之后,然后就像一个“烫手山芋”跳到另一个叫做Drp1的蛋白质,破坏线粒体功能和分裂,神经细胞的能源大国。线粒体受损时,突触,通常需要大量的能量函数,被摧毁。这个场景会破坏神经细胞之间的通信,因此记忆和认知能力在阿尔茨海默氏症,”利普顿博士说,教授和主任Sanford-Burnham德尔·e·韦伯的神经科学、衰老和干细胞研究中心。立顿博士也是一个神经学家认为阿尔茨海默病病人在自己的临床实践,并被描述和发展美金刚胺(加入盐酸®),美国fda批准的最新治疗阿尔茨海默病的药物。
在最近的研究中,Cdk5显示执行新功能而不是以前认识不从一种蛋白质转移到另一个的能力。直到现在,Cdk5只有已知影响其他蛋白质的功能与磷酸基通过标记过程称为磷酸化。没有发送的新的研究表明,添加Cdk5也上场了,并允许它S-nitrosylate其他蛋白质,在这种情况下Drp1线粒体。最值得注意的是,没有从SNO-Cdk5 Drp1转移引发的损失突触,的电化学信号传送到其他的神经细胞神经细胞。的损失突触众所周知,与阿尔茨海默氏症的认知程度下降。
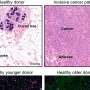
研究更进一步,团队在脑组织SNO-Cdk5水平相比从健康人群和阿尔茨海默氏症患者。SNO-Cdk5大幅提升在人类的大脑与阿尔茨海默氏症。
“我们的实验用人类脑组织从阿尔茨海默氏症给患者这一发现明确的临床意义,“立顿博士说。“SNO-Cdk5可以为治疗提供一个新的目标这毁灭性的条件。”
多达530万美国人患有阿尔茨海默氏症,目前在美国死亡的第七大原因。这项研究是由美国国立卫生研究院(NIH)。中村合作者包括静曲,“曹,艾米丽·a .荷兰,斯科特•r . McKercher斯图亚特·a·利普顿,加州拉霍亚的所有位于Sanford-Burnham。