消费者群体对乳房植入物的质疑
(美联社)——消费者安全倡导者正在质疑食品和药物管理局去年用来确认硅胶乳房植入物安全性的看似不完整和错误的数据。
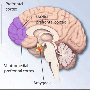
FDA在去年夏天得出结论,硅胶植入物基本上是安全的,只要女性知道她们有并发症。该机构的报告总结称,在接受隆胸手术的女性中,超过五分之一的人需要在五年内更换乳房。
今年8月,一个由医生组成的外部小组确认了FDA的决定,即该设备应继续用于丰胸和重建。
但是国家妇女和家庭研究中心表示,FDA并没有提供信息显示女性在植入后情绪、精神和身体健康状况较差。此外,该小组还质疑为什么FDA的数据显示植入并发症随着时间的推移而下降。随着时间的推移,植入物会失效。
“这表明了数据的问题,因为据报道,复杂的利率是累积的,因此应该保持相同或随着时间的推移,”小组的总统戴安娜·卢克曼(Diana Zuckerman)在FDA主管的一封信中的一封信中医疗设备部门。
FDA的大部分数据都是关于安全性和有效性的隆胸这些数据来自于两家美国设备制造商——加利福尼亚州欧文市的艾尔建公司(Allergan Inc.)和新泽西州新不伦瑞克的强生(Johnson & Johnson)旗下的门托公司(Mentor)——所做的长期研究
当美国食品药品管理局(FDA)在2005年审查该设备的最初申请时,使用爱力根植入物的女性在12项生活质量指标中的9项得分较低,这些指标包括心理、社交和一般健康。女性在性吸引力——身体自尊方面的得分确实更高。
植入强生植入物的女性在身体和心理健康方面的得分也更低。在这封11页的信中,Zuckerman质疑为什么这些信息没有在8月份的FDA公开会议上公布。
扎克曼在接受美联社采访时说:“隆胸被广泛宣传为一种增强女性自尊和积极自我感觉的方式。”“但这些植入物公司自己的数据却显示了相反的情况。FDA在2005年公布了这些数据,但去年却忽略了它们。”
在过去的20年里,硅胶乳房植入物在FDA的监管中走过了一条漫长而曲折的道路。由于担心硅胶可能导致癌症、红斑狼疮和其他疾病,FDA在1992年禁止了硅胶。十多年来,只有盐水填充的植入物可用。但当研究排除了与硅胶有关的大部分疾病时,监管机构在2006年将这种植入物重新投入市场——要求制造商继续研究患者,看他们的长期表现如何。
当FDA去年重新评估这些设备的安全性时,他们分别依靠了强生和爱力根8年和10年的随访数据。这是对2005年提交的类似数据的跟进。
随着时间的推移,乳房植入物会破裂和破裂。但是Zuckerman在她的信中指出,公司的数据似乎违背了这一趋势,并发症率随着时间的推移而下降。
例如,艾尔建报告的患者肿胀率从2005年的23%下降到了2011年的9%。留下疤痕的比例也从8%下降到4%。
Zuckerman写道:“这再次提出了报告准确性的问题,以及是否有并发症的患者被排除在10年的样本之外。”
FDA工作人员没有立即回应周四的置评请求。强生和爱力根也没有回应置评请求。
美国食品药品监督管理局(FDA)对乳房植入物的审查出现问题之际,欧洲和南美正掀起一波类似设备的召回和警告浪潮。法国公司Poly Implant Prothese的植入物由于担心会破裂并将硅胶泄漏到人体中而被撤出市场。
法国调查人员说,这家现已倒闭的公司使用的是廉价的工业硅胶,而不是医用级硅胶,而且法国有1000多名妇女的一到两次植入物破裂。法国卫生官员已经同意支付大约3万英镑女性在法国进行移植手术。
进一步探索
©2012美联社。保留所有权利。本材料不得出版、广播、改写或重新分发。













用户评论