基因治疗研究治愈狗视网膜色素变性
宾夕法尼亚大学的一个研究小组的成员已经证明,他们可以预防甚至逆转狗身上的一种致盲视网膜疾病,X-linked retininitis Pigmentosa,简称XLRP。
人类和狗的这种疾病是由RPGR基因缺陷引起的,并导致早期、严重和进行性视力丧失。它是人类最常见的视网膜变性遗传形式之一。
该研究的主要作者、宾夕法尼亚大学兽医学院眼科助理教授威廉·贝尔特兰说:“狗身上的每一个异常特征在经过治疗后都得到了纠正。”
“我们很激动,”资深作家古斯塔沃·阿吉雷说医学遗传学以及宾夕法尼亚大学兽医学院的眼科“经过处理的细胞完全正常,而这种效果是将正常的人类基因导入病变细胞的结果。感光细胞。"
人类和狗在眼部解剖、生理、疾病特征以及对这种基因治疗的积极反应方面的相似之处,为人类治疗开辟一条明确的道路带来了希望。
Beltran和Aguirre与宾夕法尼亚大学佩雷尔曼医学院的Scheie眼科研究所的Artur Cideciyan和Samuel Jacobson合作。这一成就是宾夕法尼亚大学兽医学院和医学院以及佛罗里达大学的科学家们10多年来密切合作的结果。
除了宾夕法尼亚大学、谢伊大学和佛罗里达大学的其他研究人员,密歇根大学和马萨诸塞州大学以及美国国立卫生研究院(National Institutes of Health)的国家眼科研究所(National Eye Institute)的研究人员也对这项研究做出了贡献。
这项研究将发表在该杂志上美国国家科学院院刊。
使用的基因治疗方法利用了一个病毒载体-一种转基因病毒,不会导致疾病,也不能分裂-将治疗性的RPGR基因专门传递到患病的视杆细胞和视锥细胞。如果不进行治疗,这些细胞就会发生功能障碍并逐渐死亡。
该研究小组此前曾成功地将类似的方法应用于人类和狗身上发生的另外两种遗传性视力障碍:莱伯氏先天性黑蒙和色盲。目前的研究更具挑战性,因为需要针对两种主要类型的感光细胞。
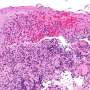
虽然XLRP的RPGR形式的确切疾病机制仍不清楚,但研究人员能够成功治疗两种不同RPGR突变的狗。这些突变以不同的方式破坏光感受器,但最终都导致它们对视觉无用。虽然这种失明在狗身上很少见,但在人类身上很常见。XLRP患者通常在儿童时期就开始失去夜视能力,到中年时几乎完全失明。
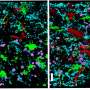
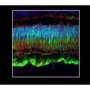
这是第一个证明这种情况在动物模型中是可以治疗的;单视网膜下注射给病狗导致功能和结构恢复。这些狗的恢复情况通过多种临床治疗方法进行评估,如视网膜电成像和光学相干断层扫描。
研究人员认为这些结果很有前景,可以应用于临床。
“我们正在干预治疗两类感光细胞,杆状细胞和锥状细胞,这是以前从未在大型动物模型中做过的,”Beltran说。“我们不仅可以预防疾病的发生,而且还可以在疾病发生时使剩余的光感受器细胞恢复正常。”
虽然修复视杆细胞和视锥细胞的能力本身是第一次,但研究团队进一步表明,这种治疗还修复了与其他视网膜神经元的光感受器连接,最终将视觉信号发送到大脑,这是另一个第一次。
阿吉雷说:“这不仅为逆转XLRP提供了希望,而且可能为任何形式的感光细胞退化提供了可能。”“视网膜内线路的改变是这些疾病的一个普遍特征,被认为是不可逆转的。
“这项研究需要结合遗传工具和外科技术,以确保治疗只针对病变细胞。病毒载体必须被注射到视网膜下间隙,以便接近光感受器。同样,你需要最终将治疗送到视网膜的正确位置,”阿吉雷说。
“在人类疾病中,仔细描述需要治疗的视网膜区域将是临床治疗成功的关键,”Cideciyan说。
在这项研究中使用的病毒载体的遗传方面涉及双重保护。第一个安全特性是使用已知的主要针对视杆细胞和视锥细胞而非其他细胞的病毒载体。第二种保护措施是将健康的RPGR基因连接到一个“启动子”上,这是一段只有在病毒侵入正确的细胞时才能“启动”该基因的遗传密码。
选择正确的启动子是关键;佛罗里达大学(University of Florida)的首席研究员威廉·w·豪斯沃思(William W. Hauswirth)和阿尔弗雷德·s·卢因(Alfred S. Lewin)必须找到一种只在视杆细胞和视锥细胞中启动的机制。通过这种方式,即使病毒进入非感光细胞,该细胞也不会开始激活RPGR基因。
启动子和它激活的RPGR基因都取自人类,这是一个强烈的信号,表明这种治疗方法可能适用于患者。
Jacobson说:“尽管仍有很多工作要做来评估这种方法的长期有效性和安全性,但希望这种载体和知识可以在几年内用于治疗许多因XLRP而失明的患者。”










用户评论