研究人员开发了基因疗法来促进对脱髓鞘疾病的大脑修复
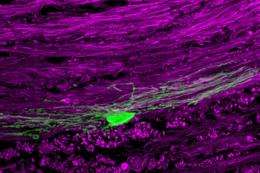
(欧宝娱乐地址Medical Xpress)——我们的身体充满了微小的超级英雄——对抗外来入侵者的抗体,再生的细胞,以及确保我们系统平稳运行的结构。髓鞘就是这样一种结构,它在神经细胞的轴突周围形成一种保护性的绝缘斗篷,使它们能够快速有效地发送信号。但是髓磷脂和制造髓磷脂的特殊细胞——少突胶质细胞——在多发性硬化症(MS)等脱髓鞘疾病中受损,导致神经元失去髓磷脂鞘。结果,受影响的神经元不能再正确地沟通,容易受到损伤。加州理工学院(Caltech)的研究人员现在相信他们已经找到了一种方法来帮助大脑替换受损的少突胶质细胞和髓磷脂。
该疗法已经成功地促进了多发性硬化症小鼠模型的再髓鞘再生,概述在2月8日发表的一篇论文的神经科学杂志》上。
“我们已经开发了一种基因疗法,可以刺激从干细胞和祖细胞中产生新的少突胶质细胞——这两种细胞都可以变成更特殊的细胞类型——这些细胞存在于成年中枢神经系统中,”加州理工学院生物学博士后、论文第一作者本杰明·德弗曼(Benjamin Deverman)说。“换句话说,我们正在利用大脑自身的祖细胞来促进修复。”
该疗法使用白血病抑制因子(LIF),这是一种自然发生的蛋白质,已知可以促进神经干细胞的自我更新,并减少免疫细胞对其他MS小鼠模型髓鞘的攻击。
加州理工学院Biaggini生物科学教授、该研究的资深作者保罗·帕特森(Paul Patterson)说:“在我们的研究之前,没有做过的是在大脑中使用基因疗法来刺激这些细胞重新髓鞘化。”
根据研究人员的说法,LIF通过刺激少突胶质细胞祖细胞增殖并产生新的少突胶质细胞来实现再髓鞘再生。大脑有能力产生少突胶质细胞,但往往不能在脱髓鞘后引起足够高的修复反应。
Deverman说:“研究人员一直怀疑,单个因素可能导致受损细胞的再髓鞘。”“人们认为可以使用因子来刺激祖细胞的分裂和扩张,然后添加其他因子来指导这些祖细胞变成成熟的髓鞘形成细胞。但在我们的小鼠模型中,当我们给予LIF治疗时,它既刺激了祖细胞的增殖,又允许它们分化为成熟的少突胶质细胞。”
换句话说,一旦研究人员刺激了祖细胞的增殖,似乎祖细胞就知道需要什么了——研究小组不需要在细胞发育的每个阶段指导细胞。他们发现,LIF引发了如此强烈的反应,以至于经过治疗的大脑中产生髓磷脂的少突胶质细胞的水平恢复到了健康人群中的水平。
研究人员还指出,通过将LIF直接放入大脑,避免了在将疗法注入血液时可能出现的潜在副作用。
Deverman说:“LIF的这种新应用是一种尚未在多发性硬化症患者身上探索过的治疗方法。”他指出,LIF的益处可能对脊髓损伤患者也有好处,因为幸免的神经元脱髓鞘可能导致该疾病的残疾。
为了使这项研究更接近人体临床试验,该团队将致力于构建更好的病毒载体来传递LIF。帕特森解释说:“这种基因疗法的工作方式是使用一种病毒,这种病毒可以将遗传物质lif送入细胞。”“这种方法以前曾用于人类,但令人担忧的是,你无法控制病毒。你不一定要锁定正确的位置,你也不能控制产生多少蛋白质。”
这就是为什么他和Deverman正在开发一种病毒,这种病毒可以针对特定类型的细胞产生LIF,并可以在外部开启和关闭它,提供了一种调节LIF水平的方法。他们还计划在其他多发性硬化症小鼠模型上测试这种疗法。
Deverman说:“对于多发性硬化症,目前的治疗方法都是通过调节或抑制免疫系统来起作用的,因为这被认为是一种炎症导致免疫相关的少突胶质细胞丢失和神经元损伤的疾病。”“这些疗法可以降低患者的复发率,但它们尚未显示出对疾病的长期进展有多大影响。”我们需要的是促进修复的疗法。我们希望有一天这也能成为一种治疗方法。”
进一步探索







用户评论