发现了未检查的血管生成背后的罪魁祸首
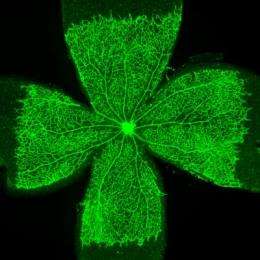
德国研究人员揭示了控制血管生长的关键调控机制,这可能有助于解决未来的耐药性问题。
血管生成,即新血管的生长,是一个复杂的过程,在这个过程中,不同的信号蛋白以高度协调的方式相互作用。生长因子VEGF和Notch信号通路都在这一过程中发挥重要作用。VEGF通过结合其受体VEGFR2促进血管生长,而Notch信号通路就像一个开关,能够抑制血管生成。直到最近,科学家们一直认为Notch通过下调VEGFR2来消除VEGF的影响。现在,研究人员在马克斯·普朗克研究所分子生物医学和位于德国Münster的威斯特伐利亚威廉大学能够证明,即使在VEGF或VEGFR2被抑制的情况下,缺陷的Notch信号也能使强大且不受调控的血管生长。在这种情况下,另一种VEGF家族受体VEGFR3被强烈上调,促进血管生成。这一发现可能有助于解释这一现象耐药性MPI的执行主任、组织生物学和形态发生系主任拉尔夫·亚当斯建议说:“这是一种新的治疗策略。
广泛分支的血管网络为身体的每个器官提供营养,并从组织中清除有害的代谢废物。这个血管系统的生长对于伤口的发育和愈合过程是必不可少的。不受控制的血管生成会导致血管瘤(皮肤中血管的海绵状过度生长)或视网膜病变(损害糖尿病患者和老年人的视力)等疾病。在癌症治疗中,抑制血管生成被用来抑制肿瘤,防止癌细胞通过循环转移扩散。目前,最常用的方法是靶向VEGF或其受体VEGFR2。当氧气供应不足时,组织开始释放VEGF, VEGF与VEGFR2结合,激活受体,从而触发血管生长。因此,可以通过抑制VEGF或VEGFR2来阻止新血管的形成。不幸的是,现有的治疗方法是不充分的,而且由于尚不清楚的原因,一些患者对VEGF/VEGFR2抑制反应很差或根本没有反应。
现在,亚当斯系博士后研究员Rui Benedito已经证明,即使在VEGF或VEGFR2被抑制的情况下,抑制小鼠眼睛血管中的Notch通路也能使血管生长强劲且不受调控。“事实证明,另一种VEGF家族受体VEGFR3接管了,促进了新血管的形成,”贝内迪托解释说。VEGFR3在血管即使没有周围组织的生长信号,它也很活跃。
“我们现在需要做的是确认VEGFR3和其他notch调控信号是否真的能够促进vegf独立船的增长不仅在小鼠,而且在人类的眼疾或癌症中,”亚当斯解释道。“根据患者的血管Notch激活状态,预测患者是否会对VEGF或VEGFR2抑制产生反应可能成为可能。这将允许医生在必要时选择替代疗法。在这方面,MPI、医学院和Münster大学之间的合作也是必不可少的:“我们的工作得益于大学提供的优秀支持。”
进一步探索