代谢蛋白利用磷酸基激活促癌基因
由德克萨斯大学MD安德森癌症中心的科学家领导的研究小组在8月16日的《美国医学杂志》上报道,一种滋养癌细胞的代谢蛋白也通过松动组成染色体的DNA包装来激活肿瘤促进基因细胞.
在细胞系和小鼠模型中工作多形性成胶质细胞瘤MD Anderson的神经肿瘤学副教授、资深作者Zhimin Lu博士和他的同事指出,丙酮酸激酶M2 (PKM2)通过影响一种组蛋白促进肿瘤生长。
DNA被包裹在里面,绕着绕着组蛋白蛋白质.研究人员发现,PKM2在名为T11的特定位置用磷酸基团(一个磷原子,四个氧原子)标记组蛋白H3。
“没有H3磷酸化,就没有肿瘤”
这种磷酸化导致了肿瘤促进基因的激活,增加了肿瘤细胞的繁殖和肿瘤的形成,Lu说。“如果没有H3的磷酸化,就不会有肿瘤。这对胶质母细胞瘤的形成至关重要。”
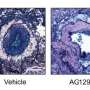
对85例人胶质母细胞瘤的分析表明,PKM2表达水平较高细胞核和H3磷酸化水平与较短的生存期相关。一项单独的分析显示,在30个低级别肿瘤样本和45个高级别胶质母细胞瘤的比较中,H3磷酸化水平较高与级别较高的肿瘤相关。
“组蛋白3-T11磷酸化有很大的潜力作为一种预后标记以及一旦开发出pkm2抑制疗法,如何使用它们的指南,”Lu说。
PKM2因其在好氧糖酵解过程中的作用而为人所知。好氧糖酵解是将葡萄糖转化为能量的过程,实体肿瘤,特别是胶质母细胞瘤,严重依赖能量生存和生长。Lu和他的同事们一直在梳理PKM2的其他作用机制——基因的转录和激活。
这一切都始于EGFR
当表皮生长因子受体(EGFR)在细胞膜上被一种生长因子激活,PKM2蛋白进入细胞核,在那里它与基因的启动子区域结合。其他被称为转录因子的蛋白质附着在基因的启动子区域上激活它。
癌症细胞细胞表面有高水平的表皮生长因子受体,从细胞外向细胞内传递生长信号。EGFR本身就是一些抗癌药物的靶点。
研究小组的一系列实验揭示了以下分子步骤:
- EGFR激活后,PKM2与组蛋白H3结合,并在T11处附着一个磷酸基。
- 这将另一种叫做组蛋白去乙酰化酶3 (HDAC3)的蛋白质从基因CCND1和MYC的启动子区分离出来。HDACs阻断基因激活。
- HDACs消失后,组蛋白H3获得一个乙酰基,这有利于基因激活。
阻断磷酸化可以预防小鼠的脑瘤
CCND1表达细胞周期蛋白D1,一种细胞周期调节剂。MYC基因在癌症中经常发生突变,导致转录因子MYC的过表达,这反过来又导致许多其他基因的表达不规范。
在egfr驱动的胶质母细胞瘤的小鼠实验中,使用重组的H3组蛋白(一个正常组蛋白和一个H3- t11a突变组蛋白,以阻止PKM2的磷酸化)证实了这一关系。注射正常或野生型H3的小鼠,肿瘤的平均体积接近40立方毫米,而那些T11A失活的小鼠,阻断了PKM2的磷酸化点,没有肿瘤。
“我们的研究结果证实PKM2是一种组蛋白激酶,它直接调节基因转录,控制细胞周期的进展和肿瘤细胞的增殖。”激酶是一类将磷酸基团附着在其他蛋白质上的蛋白质。











用户评论