人体自身的循环系统:研究人员发现负责调节自我消化的“分子紧急刹车”
遇险的时间在字面上吃掉了饥饿细胞的核心:他们开始消化自己的零件并回收它们进行代谢目的。Ingo Schmitz在德国Braunschweig的Helmholtz感染研究中心,与一支研究人员一起,发现“分子制动器”负责调节自噬,以防止失控。他们在科学期刊上发表了他们的调查结果,细胞死亡与分化。
细胞内发生的几乎所有事情,包括自噬,都在生化水平上受到严格的调控。像这样,细胞确保进程只在需要它们的时候发生,并且在需要过期的时候关闭它们。“在细胞内部,存在着一个分子网络。HZI“系统导向免疫学和炎症研究”研究小组的负责人Schmitz说,他同时也是马格德堡奥托·冯·格里克大学的主席。“在某种程度上,它看起来就像一张大城市的地铁地图。”然而,只有给定的“蜂窝地铁线路”的起点和终点比较容易研究。要探索沿途的不同驿站,是比较困难的。但是由于其他的线在这些点相交并相互作用,对研究人员来说,解码参与这些信号转导过程的所有分子是非常令人兴奋的。这也有助于他们更好地了解由这些信息高速公路缺陷引起的疾病。
在自噬后来阶段的分子水平上究竟发生了什么,主要是未知 - 直到现在。Schmitz和他的团队以及来自Usto von Guericke University的Otto Von Gueaceke University杜塞尔多大学杜塞尔多夫,廷根大学和寺庙大学在美国费城的寺庙大学医学院,已经解锁了分子地铁地图的一部分。
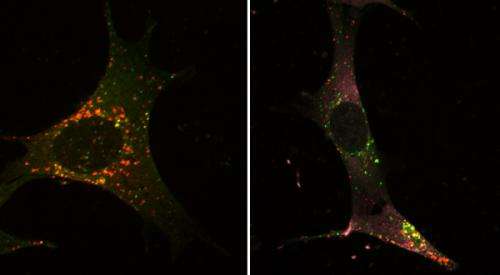
在显微镜下,研究人员可以观察到将被降解和再循环的更大尺寸的细胞成分是如何被封闭在一个小气泡中,即所谓的自噬体。然后这个结构与另一个小气泡融合,这个小气泡消化自噬体的内容物。Schmitz解释说:“自噬是一种生存机制,确保细胞在饥饿时能够获得必要的营养。”
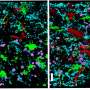
对于他们的学习,科学家们在细胞内染色了某些分子和自噬细胞。这允许它们观察微静脉上,这些分子负责调节小消化泡的形成。为了提示自我消化,它们要么饿死细胞或模拟感染。在该过程中,他们发现细胞同时也打开自噬抑制分子 - “像某种应急制动器一样,确保自噬不会失控。”这种负面反馈循环并不罕见细胞,它们常常有助于防止反应过度。
研究人员设法确定了这个反馈回路的组成部分,并发现一种名为p38的蛋白质在这个过程中发挥了关键作用。科学家们在自噬体表面观察到的p38蛋白尤其让他们感到惊讶。正常情况下,这种蛋白质位于细胞核内,每当细胞受到压力时,它就会被激活。在自噬体的表面,p38起着非常不同的作用:它改变另一个叫做Atg5的分子,让它阻止自噬的最后一步,包括小消化泡的形成。自噬被抑制,从本质上说,细胞拉起了“分子紧急刹车”。
如果没有,可能会导致疾病。因此,Atg家族的缺陷分子与炎症性肠病(克罗恩病)的病因有关。“在出生后不久就死于营养缺乏的atg5缺陷小鼠中,我们看到了严格管理是多么重要自噬该研究的第一作者之一拉尔夫Höcker强调说。就像很多时候一样,在过多和过少的自我消化之间找到适当的平衡是很重要的。
进一步探索









用户评论