研究人员调查阿尔茨海默病背后的淀粉样蛋白-肽

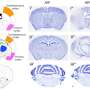
通过使用固态核磁共振(NMR)波谱,Luleå科技大学与英国华威大学的研究人员在世界上首次成功分析了淀粉样- β肽微小原纤维中的氢键,而淀粉样- β肽可能导致阿尔茨海默病。多亏了这些新结果,我们有了一种成功的方法来分析淀粉样肽的结构,即当它们对大脑神经元最危险的时候,它们的毒性最大。
Luleå科技大学界面化学教授Oleg N. Antzutkin说:“这是在分子水平上研究阿尔茨海默氏症的非常重要的一步。”
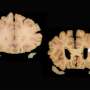
直到几年前,科学家们才相信这一点淀粉样斑块直接导致阿尔茨海默病这是因为阿尔茨海默病患者的大脑中通常会发现大量的斑块。由于我们大脑中负责短期记忆的区域最活跃,所以在那里发现了大部分淀粉样斑块。这里通常也是阿尔茨海默氏症最初被发现的地方,表现为短期记忆减退。然而,似乎淀粉样斑块是某种更糟糕的东西的残留。
现在我们知道它是淀粉样斑块的前体,淀粉样- β肽会导致阿尔茨海默病患者大脑中的神经细胞死亡。当淀粉样蛋白,形成小的聚集体,低聚物,即在肽之前团一起形成斑块,它是毒性最强的大脑神经元。这已被展示试管实验。
然而,分子结构对于淀粉样蛋白β肽的这些微小的低聚物,今天尚不清楚。因此,难以设计抗体或药物以击中右侧靶位,并且能够在引起阿尔茨海默病之前消除或阻止这些有毒的低聚物。
迄今为止,还没有一种成功的方法来解决这些分子结构:
“现在我们有了一种方法,可以用来识别特异性氢键在淀粉样β蛋白原纤维从而区分淀粉样原纤维的不同超分子结构。以前的方法不能直接探测这些氢键。使用我们的方法,很快就可以研究有毒低聚物关键片段中的氢键,这将有助于解决它们的超分子结构。我们现在所做的,是迈向低聚物完整结构表征的重要一步。
Luleå科技大学已经开始了与瑞典乌普萨拉农业科学大学Torleif教授Härd的团队,华威大学和奥尔胡斯大学就后一个课题的合作。
通过检查淀粉样原纤维和低聚物中的氢键,借助核磁共振安祖特金(Oleg N. Antzutkin)教授和他的研究团队开发出了一种方法,为设计淀粉样蛋白聚集体的终结者或阻滞剂提供了一个真正的机会,在淀粉样蛋白聚集体成为对神经细胞毒性最强、导致阿尔茨海默病(Alzheimer's disease)之前。
每年大约有8万瑞典人被诊断出患有阿尔茨海默氏症,这是一种严重的痴呆症。目前可用的药物不能治愈这种疾病,只能减轻症状。
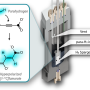
氢键在生物系统的分子和超分子结构的稳定中是必不可少的。通过REAPDOR固态核磁共振光谱学Oleg N. Antzutkin教授和他的团队已经成功地测量了淀粉样原纤维中氨基和羰基中磁性同位素15N和17O之间的距离。简单地说,15N和17O富集氨基酸的15N NMR信号减少,当15N和17O在空间上接近时,表明存在氢键。
进一步探索







用户评论