ALS TDI和格莱斯顿机构合作以发现潜在的肌萎缩性侧索硬化症的治疗方法
肌萎缩性侧索硬化症治疗发展研究所(ALS TDI)和格莱斯顿研究院今天宣布成立科研合作的速度发现潜在的治疗ALS完成临床前药物开发过程。
“我们激动的是潜在的这种合作加速肌萎缩性侧索硬化症治疗的发展,”Steve佩兰说博士,首席执行官和首席科学官ALS TDI。“我们的组织有独特的基础设施和连接他们这种方式,我们可以提前潜在治疗的速度比以前更快了。”
肌萎缩性脊髓侧索硬化症(ALS),也被称为卢伽雷氏症,是一种神经退行性疾病,会导致瘫痪,最终引起死亡的损失运动神经元在脊髓和大脑。在美国大约有30000人生活在这种疾病在任何给定的时间,和ALS患者的全球人口大约是400000。大约有5000新发病例肌萎缩性侧索硬化症诊断每年在美国,和没有已知的原因,治疗或治疗停止或逆转疾病。普通患者在诊断后存活的唯一2到5年。
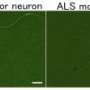
根据新协议,立即开始,格莱斯顿将评估的潜力制药化合物使用ALS的人体模型。格拉德斯通生成转换的模型皮肤细胞从ALS患者干细胞,称为诱导多能干细胞(“诱导多能性”细胞),然后编程成神经元。技术建立在发现Shinya Yamanaka,医学博士,博士,格莱斯顿的高级研究员,赢得了2012年诺贝尔生理学或医学奖。
这个特殊的iPS-based ALS模型包括一个基因突变生产TDP-43,蛋白质通常存在于大多数形式的肌萎缩性侧索硬化症。有前途的药物化合物格莱斯顿通过最初的评估过程将很快在ALS TDI临床前测试,将评估活动和功效的化合物在各种人类神经退化的小鼠模型。
“我们希望人类的ALS模型将帮助我们迅速和有效地识别有前途的治疗ALS候选人,“高级调查员史蒂夫·芬克贝涅格莱斯顿说医学博士,同时也是神经学和生理学教授,加州大学旧金山,格莱斯顿的附属。“强有力的证据表明,异常TDP-43蛋白质参与ALS的发展,加上模型可能忠实地复制ALS比其他工具,可能速度发展治疗成千上万的个体诊断出患有这种毁灭性疾病。”