酶凸轮激酶II放松肌肉细胞:研究人员在失败的心中找到了过度活跃的酶
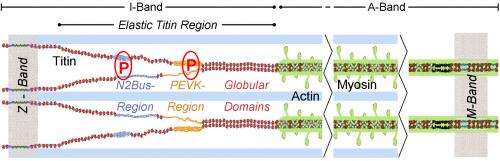
有一种特定的酶,即CaM激酶II,使心肌保持弹性。通过将磷酸基转移到巨大的肌凝蛋白上,它使肌肉细胞放松。鲁尔生理学研究所的沃尔夫冈·林克教授领导的研究人员在杂志Universität上发表了这一研究结果流通研究。
在失败的心中,这不泵在身体周围足够的血液中,科学家发现了一种过于活性的凸轮激酶II。“三肽的磷酸化可能是治疗的新起点心脏衰竭林克教授推测道。
肌凝素磷酸化决定了肌细胞的机械张力
三肽是人体中最大的蛋白质,它像弹簧一样动作,肌肉细胞动脉细胞。将磷酸基团与特定的磷酸肽位点的连接 - 称为磷酸化 - 松弛细胞。已知钙/钙调蛋白依赖性激酶II,凸轮激酶II短,磷酸化在心脏细胞中的几种蛋白质。它还针对春季蛋白三汀,现在已经被霍奇的研究人员审查。
CaM-Kinase II磷酸化巨大的肌凝蛋白
对于研究,研究人员使用心脏细胞“正常”小鼠,没有CaM激酶II的小鼠,以及比正常小鼠产生更多CaM激酶II的小鼠。在没有这种酶的细胞中,与正常状态相比,肌动蛋白磷酸化降低了50%以上。然而,在酶过剩的细胞中,肌动蛋白磷酸化是正常细胞的两倍。因此,CaM激酶II对于磷酸基连接到巨大的肌凝蛋白是至关重要的。Linke的研究小组在肌凝素分子的柔性段中确定了两个被酶磷酸化的区域,即PEVK和N2Bus区域。这些站点包含以下几个氨基酸丝氨酸和苏氨酸在进化过程中变化不大。
凸轮激酶II的工作决定了细胞刚度
在进一步的分析中,研究小组还表明,CaM激酶II的缺乏或过量会影响细胞的硬度肌细胞。没有酶的细胞更硬,有酶的细胞更灵活。如果他们把CaM激酶II添加到不能产生这种酶的细胞中,这些细胞就会松弛。在衰竭的人类心脏中,研究小组发现,与健康心脏相比,CaM激酶II的活性增加,因此过量磷酸化在PEVK和N2BUS标题区域。“这似乎改变了人类心肌的力学性质”,沃尔夫冈林克说。
进一步探索








用户评论