一种与常见运动神经元疾病发病年龄相关的错误折叠蛋白的稳定性增加
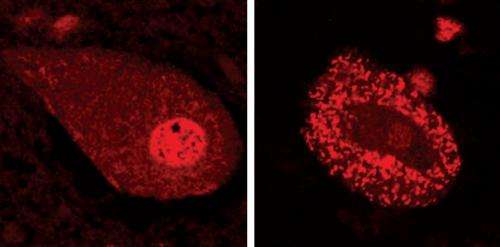
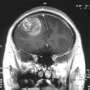
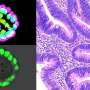
神经退行性疾病的特征是错误折叠的蛋白质聚集,这些蛋白质积累在神经细胞内或周围形成不可溶解的团块。例如,在成人运动神经元疾病肌萎缩性侧索硬化症(ALS)中,这种聚集是由TDP-43蛋白的错误折叠形成的(图1)。已知导致遗传性ALS的突变起源于编码TDP-43蛋白的基因,但TDP-43的生化特性与ALS进展之间的关系尚不清楚。
Koji Yamanaka及其同事的新研究运动神经元病理研脑科学研究所的研究人员发现,突变体TDP-43的稳定性增加与ALS的早期发病有关。
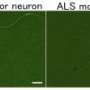
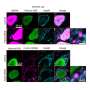
山中伸弥和他的同事分离出了人类TDP-43基因,并使用基因工程引入了7种不同的突变,这些突变此前已在遗传性渐冻症患者中发现。然后,他们将突变基因导入在培养皿中生长的神经元中,以诱导细胞合成突变蛋白质。
他们发现突变版本的TDP-43比正常形式的稳定得多,其半衰期高达正常蛋白质的四倍。这种增加的稳定性也使得突变体TDP-43分子对细胞的毒性更强。
研究人员随后筛选了81例遗传性ALS患者的临床信息,以确定突变蛋白的稳定性是否与发病年龄有关。结果显示,携带TDP-43突变且半衰期较长的患者在较早的年龄发病。
错误折叠的蛋白质通常被a识别并靶向破坏细胞结构叫做蛋白酶体细胞损伤.Yamanaka的小组发现TDP-43稳定了蛋白质分子抑制蛋白酶体活动,从而增加了越来越多的证据表明,这种清除机制失败神经退行性疾病.他们还发现,稳定的TDP-43蛋白失去了控制自身mRNA转录的能力,从而进一步加速了其积累。
细胞培养实验提供了一种新的模型,可用于控制TDP-43的稳定性,并可以进一步了解蛋白质稳定性对疾病发生和进展机制的重要性。
山中伸弥说:“阐明稳定的机制和后果将为ALS中运动神经元退化是如何开始的提供一个机械的观点。”“我们现在正在研究毒性机制,以及改善神经元死亡的治疗手段。”
进一步探索







用户评论