第三代装置显着改善了循环肿瘤细胞的捕获
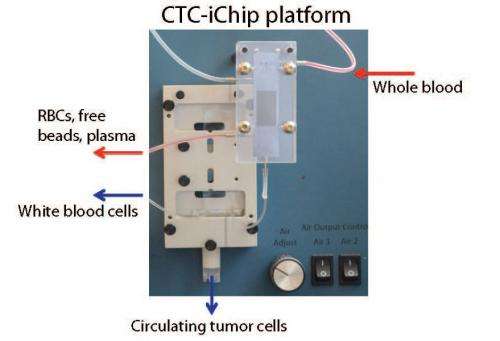
一种分离罕见循环肿瘤细胞(CTCs)的新系统——在血液中发现的低水平的活体实体肿瘤细胞——比以前开发的设备有了显著的改进,并且不需要预先识别肿瘤特异性靶分子。该设备由麻省总医院(MGH)医学工程中心和MGH癌症中心开发,该设备快速提供了一组未标记的肿瘤细胞,可以通过标准的临床诊断细胞病理学和先进的遗传和分子技术进行分析。MGH团队的报告已经发表在科学转化医学。
“这项新技术让我们可以遵循癌症细胞改变的过程转移MGH医学工程中心生物机电系统资源中心主任、论文的资深作者Mehmet Toner博士说。“癌症在转移过程中失去了许多组织特征,这一过程我们还不太清楚。现在我们第一次有能力通过分析单个个体来发现癌症是如何演变的转移性细胞这是对抗癌症的一大步。”
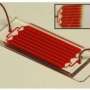
这种被称为ctc芯片的新设备是MGH医学工程中心开发的第三种基于微芯片的捕获ctc的设备。前两个系统是依靠的先验知识为了从全血中筛选ctc,需要对每一种不同类型的癌症进行重大调整。该系统还需要4到5个小时来处理单个血液样本。
Veridex公司开发的CELLSEARCH系统是唯一获得美国食品和药物管理局批准的商用捕获和枚举CTCs的设备。该系统依赖于磁性纳米颗粒,与MGH中使用的相同上皮蛋白结合微芯片基于ctc的设备,并不能总是发现ctc的数量非常低。2011年1月,MGH与Veridex及其附属Janssen研发有限责任公司签订了一项合作协议,以建立一个卓越的CTC技术研究中心。
结合了这两种方法的元素——目标细胞的磁性标记和微流控分选——ctc芯片的工作原理是将血液样本经过三个阶段。首先,根据细胞大小,从样本中除去除ctc和白细胞以外的所有血液成分。第二步使用MGH开发的微流体过程,将细胞排列在单个文件中,允许极其精确和快速的分类。在第三阶段,磁性标记的目标细胞——无论是通过上皮标记标记的ctc,还是在已知血细胞抗原上标记的白细胞——被分类出来。标记白细胞而不是ctc会留下一群未标记和未改变的肿瘤细胞,并且不依赖于上皮标记物或细胞表面其他已知的肿瘤抗原的存在。
新系统能够以每秒1000万个细胞的极快速度处理血液样本,处理一管血液不到一小时。筛选标记ctc(肿瘤抗原依赖)的模式,以及耗尽白细胞(肿瘤抗原不依赖)的技术,都从添加到血液样本的不同类型癌症中恢复了80%以上的肿瘤细胞。抗原依赖模式ctc - chip与现有商业技术处理前列腺癌、乳腺癌、胰腺癌、结肠直肠癌和肺癌患者血液样本的比较显示,ctc - chip在检测低水平ctc时更加敏感。
在抗原独立模式中,ctc - chip成功地从几种失去或从未有上皮标记的癌症中识别出ctc,包括三阴性乳腺癌和黑色素瘤。通过该模式分离的CTCs进行标准的细胞病理学分析,发现其结构与原发肿瘤相似,并对单个患者的CTCs进行详细的分子基因分型,发现单个CTCs的基因表达模式存在显著差异。
“我们只开始识别分析肿瘤在传播时变异的能力的潜在应用,但这应该有助于提高我们对转移基本遗传原则的理解,”哈佛医学院手术的本笃会教授(HMS)。“我们希望能够向早期诊断提供这种技术,这是我们对CTC技术致力于努力的”圣杯“。”
MGH循环肿瘤细胞中心创新团队的工程中心博士博士表示,“CTC-Ichip”为高效,高速肿瘤提供了一流的装置从临床相关的血容量中排序。该芯片专为大规模制造而设计,简单的临床翻译自动化。“该团队正在与Veridex和Janssen的合作者合作,优化商业发展系统。
研究合著者Daniel Haber,医学博士,MGH癌症中心主任,HMS的Isselbacher/Schwartz肿瘤学教授,补充说:“癌症转移的研究由于无法快速可靠地分离而受到限制肿瘤细胞在运输途中血。这种新方法可能会改变该领域的游戏规则。”
进一步探索








用户评论