当氧短,表皮生长因子受体阻止抗癌microrna的成熟
即使被拖入毁灭在一个细胞,促进生长因子受体火灾,发送信号,阻止抑制肿瘤的发展小分子核糖核酸(microrna)解散之前,研究人员报告在早期在线出版自然。
条件下氧饥饿经常遇到的肿瘤,表皮生长因子受体(EGFR)牙龈细胞microrna的加工机械,一个国际研究小组由德克萨斯大学MD安德森癌症中心的科学家们发现。
”所以当缺氧强调一个细胞,表皮生长因子受体信号的防止未成熟的microrna抗癌长大,“Mien-Chie挂资深作者说,博士,教授和主席MD安德森的分子和细胞肿瘤学和持有人的露丝Legett琼斯杰出的椅子上。
该集团的结果指向一个潜在的新预后标记挂指出,乳腺癌,但也提供了第一个证据的生长因子信号通路调节microrna的成熟。
“内部的细胞,你有感应信号,通过表皮生长因子受体在这种情况下,你也有一个处理前体蛋白复合物为成熟microrna的执行一个函数。他们没有交谈,就好像一个说英语和其他中国,”洪说。“这是第一篇论文展示他们如何交流。”
在细胞系实验中科学家们建立了关系,证实在小鼠模型和人类乳腺癌样本,然后发现它减少乳腺癌患者生存在回顾125例。
一个新的促进角色对表皮生长因子受体识别
EGFR穿透细胞膜接收信号从细胞外的生长因子。生长因子结合后,表皮生长因子受体信号传递到细胞通过附加磷酸基与其他蛋白质,通常作为分子“开关”。
在许多癌症,EGFR过表达或功能失调,不断地发送信号到细胞分裂。挂着和他的同事也发现表皮生长因子受体的抑制肿瘤抑制燃料癌症进程的microrna。
随着肿瘤的增长,大部分的内部可能会缺氧(缺氧)缺乏足够的血管。这压力扼杀了许多肿瘤细胞,但少数忍受成为高度恶性,抵抗治疗和最有可能蔓延,洪说。
杀死肿瘤的抗血管生成药物设计通过阻断他们的自旋网络支持血管的能力常常成功,挂着说,然后失败更恶性细胞生存缺氧。
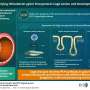
缺氧时,表皮生长因子受体变得活跃,被吃掉
低氧环境导致表皮生长因子受体超表达。表皮生长因子受体也拉到细胞内部,在蛀牙囊泡和捕获最终送入溶酶体,一个membrane-enclosed细胞器含有溶解酶蛋白质。
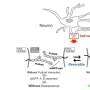
众所周知,EGFR继续信号即使在囊泡,实际上是延长其激活。挂着和他的同事们发现表皮生长因子受体信号microrna的关键蛋白质加工叫作argonaute 2,或AGO2。
AGO2与另外两个蛋白质称为小礼帽和TRBP形成一个复杂的微RNA前体处理为成熟的microRNA,调节基因的表达的信使RNA表达后但在翻译成蛋白质。
Oncoprotein-regulating microrna不要长大
科学家发现,表皮生长因子受体高度磷酸基AGO2,进而削弱AGO2与帽子的能力产生成熟的小分子核糖核酸。表皮生长因子受体的影响比在正常情况下强在缺氧状态。
研究小组发现了一个特定的microrna表皮生长因子受体的影响,其中大部分已报道有肿瘤抑制的特点。包括miR-31, microrna受磷酸化AGO2 mir - 192和mir - 193 - a - 5 - p,还共享一个大圈结构的前兆,microrna影响AGO2磷酸化所缺乏的。
缺氧环境在促进肿瘤转移,帮助细胞逃避程序性细胞死亡。挂着和他的同事们研究发现,EGFR-mediated AGO2磷酸化细胞死亡和增强侵袭性缺氧。
乳腺癌的老鼠模型实验证实,表皮生长因子受体的表达和磷酸化AGO2增加在缺氧条件下肿瘤恶化。
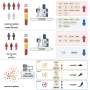
EGFR-AGO2连接中发现人类乳腺肿瘤;减少生存
hypoxia-EGFR-AGO2连接较低的肿瘤样本128名乳腺癌患者,但它很低或没有在正常乳房组织。125年乳腺癌情况下分析了团队,62年高水平的磷酸化AGO2患者存活48个月。生存中值没有达到低水平组的63名患者,但78%存活48个月。
“一个人可以想象其他的受体对血小板源生长因子和胰岛素样生长因子也调节microrna,可能通过调节帽子或TBRP,”洪说。“这是一个转折点,它会引起许多科学家追求的新问题。”