2013年6月17日报告
解码雷特综合症:解开谜团的新线索
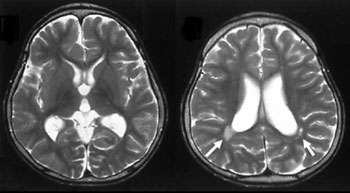
雷欧宝娱乐地址特综合症是一种神经系统疾病,大约一万名女孩中就有一人患有这种疾病。早在1992年,爱丁堡大学的研究员阿德里安·伯德(Adrian Bird)就发现,这种名为MeCP2的蛋白质在这种疾病中起着重要作用。MeCP2的故事在很多方面都是人类遗传学的缩影。它已经成为许多复杂的表观遗传现象的展示基因,包括x -连锁失活、DNA甲基化和基因组印迹。在性染色体配置本质上是不对称的进化系统中,这些性别特异性的讨价还价筹码提供了兼容性。在两篇新论文中,一篇在自然另一只进去了自然神经科学, Bird和合作者Michael Greenberg展示了在Rett综合征中发现的突变如何影响MeCP2与一种被称为NCoR的关键调控蛋白的相互作用。
几乎所有的Rett综合征病例都是由MeCP2基因不同部位的突变引起的。Bird和Greenberg分析了这些突变的位置RettBase MeCp2数据库,并发现它们聚集到两个主要位置 - 众所周知的甲基-CPG结合结构域,以及转录阻遏域(TRD)内的新热点。当他们将这些位置与一般人群中发现的突变进行比较时外显子组变异服务器,他们发现没有重叠。这表明MECP2和TRD区域是RETT中涉及的主要区域。
研究人员推测,新发现的TRD区域必须通过一种未知的MeCP2功能调节器发挥作用。利用质谱,他们能够识别从Mecp2-EGFP“敲入”小鼠中纯化的几个因子。这些因子中的大多数被证明是辅抑制因子NCoR的亚基,而NCoR先前已知与MeCP2相互作用。这是已知的第一个在Rett's中被破坏的蛋白质-蛋白质相互作用的例子。
在自然纸张,研究人员进一步报告了MECP2的活性依赖性磷酸化介导其与Ncor的相互作用。他们使用了一种已知的技术phosphotryptic mapping来识别三个因cAMP或BDNF升高而在MeCP2中直接磷酸化的位点。更普遍的是,他们表明膜去极化,因此活性,导致磷酸化。
在试图查明Rett综合征的潜在机制时,一个令人困惑的因素是MeCP2的丢失和MeCP2的过表达都可能导致这种疾病。在疾病的小鼠模型中,这可以通过观察NCoR结合的丧失和NCoR的结构性结合导致疾病症状来解释。虽然这并不能完全解释MeCP2在疾病中的作用,但它提供了一些线索,有助于解剖许多不同类型的MeCP2的参与突变参与。
尽管Rett的综合症很少,但不应低估了对我们对人类遗传和神经发展的理解的影响。作为自闭症谱系障碍之一,Rett的研究有助于将分子机制连接到行为。例如,当MECP2与DNA结合时,它会导致染色质结构的缩合,并且还形成与组蛋白脱乙酰基的复合物。在发泡中,神经活动和随后的信号制作途径导致MECP2的修改,研究人员已经直接从环境中透露了一条路径基因。
在女性中,一个MeCP2基因拷贝的x连锁失活增加了该疾病的另一层复杂性。失活模式形成的细胞马赛克,特别是在大脑中,需要更多的研究来了解。有丝分裂后神经元中MeCP2的表达可以“挽救”小鼠的Rett症状,这一事实令人鼓舞。在人类中,雷特氏症通常在出生后的头或第二年才被观察到。由于MeCP2的激活与神经的快速成熟有关,Rett's通常被认为是神经发育性疾病,而不是神经退行性疾病。
雷特氏病很少在男性中被观察到,原因很简单,他们在出生前很久就不能茁壮成长。在那些罕见的情况下,一个可能是XXY的男孩被额外的X染色体拯救,如在克兰菲尔德病,提供了罕见的机会来研究疾病的病因。这些研究者的努力,以及更大的Rett的社区,加上大量的数据整理所提供的见解,已经把一种罕见的疾病变成了关于进化是如何在遗传和表观遗传水平上通过性别的相互作用而进行的知识的主要来源。
进一步探索
摘要
Rett综合征(RTT)是一种严重的神经系统疾病,由MECP2基因突变引起。许多导致RTT的错义突变聚集在MeCP2的dna结合域,这表明与染色质的结合对其功能至关重要。我们在MeCP2的一个之前没有特征的区域发现了第二个突变簇。我们发现,该区域的RTT突变消除了MeCP2和NCoR/SMRT共抑制复合物之间的相互作用。在这一领域中携带常见错义RTT突变的小鼠表现出严重的RTT样表型。我们的数据与RTT的大脑功能障碍是由于NCoR/SMRT共抑制因子和染色质之间的MeCP2“桥”缺失而引起的假说是一致的。
2. MECP2苏氨酸308的活动依赖性磷酸化调节与NCOR的互动,自然(2013)DOI:10.1038 / Nature12348www.nature.com/nature/journal/ ... ull / nature12348.html
摘要
Rett的综合征(RTT)是一种X链接的人类神经发育障碍,具有自闭症和女性严重神经功能障碍的特征。RTT是由甲基-CPG结合蛋白2(MECP2)中的突变引起的,在神经元调节转录中的核蛋白质以与组蛋白类似的高水平表达,并在基因组上广泛地结合甲基化胞嘧啶。通过PhosPhosphyptic映射,我们识别活动依赖性MECP2磷酸化的三个站点(S86,S274和T308)。这些位点的磷酸化由神经元活性差异诱导,脑衍生的神经营养因子或升高细胞内水平的3',5'-环状疾病(营地)的药剂,表明MECP2可以用作基因表达的表观调节剂从环境中集成不同的信号。在这里,我们表明T308的磷酸化阻断了MECP2与核受体共压制(NCOR)复合物的阻遏域的相互作用,并抑制了MECP2抑制转录的能力。在携带常见的人RTT畸变突变R306C的敲击小鼠中,神经元活动未能诱导MECP2 T308磷酸化,表明T308磷酸化的损失可能导致RTT促进。与这种可能性一致,MECP2 T308a在小鼠中的突变导致活性调节基因子集和RTT样症状的诱导诱导的降低。这些发现表明,T308在T308的活性依赖性磷酸化调节MECP2与NCOR复合物的相互作用,并且人类中的RTT部分可能是由于活性依赖性MECP2 T308磷酸化的丧失和破坏用Ncor复合物磷酸化调节的MECP2与Ncor络合物相互作用。
©2013医学欧宝娱乐地址快讯












用户评论