2013年7月30日功能
病人,自愈:人体诱导多能干细胞在体内再生的功能性血管
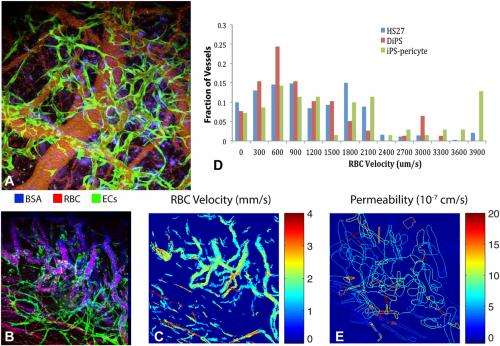
(欧宝娱乐地址医学Xpress) - 血管发生 - 通过a的血管形成的过程新创内皮细胞(ECs,即在血管和淋巴管内表面形成一层薄层的细胞)的产生是再生医学、组织工程、特别是对抗血管疾病的重要工具,而血管疾病是美国人死亡的主要原因。(超过三分之一的美国人(36.9%)患有心脏病,到2030年,预计美国将有1.16亿人(40.5%)患有某种心血管疾病。)更具体地说,在人类诱导多能干细胞(hiPS)研究中,产生功能性、长效的血管生成细胞是一个关键但难以捉摸的组成部分。然而,最近,哈佛大学和麻省总医院的研究人员成功地从健康捐赠者的hiPS细胞中提取内皮细胞,形成了稳定的功能血管在活的有机体内。此外,他们开发了一种方法,可以平行地从hiPS细胞中生成间充质前体细胞(MPCs,或多能基质,或结缔组织,可以分化为多种细胞类型,包括血管周围细胞——血管壁的另一种成分),也可以生成功能性血管在活的有机体内使用这些来自同一hiPS细胞系的内皮细胞和多能基质细胞。除此之外,在临床转化方面,该团队成功地从1型糖尿病患者来源的hiPS细胞系中生成了ec和MPCs,并使用它们来生成血管在活的有机体内。
博士。Rakesh K. Jain,Dai Fukumura和Rekha Samuel讨论了他们和他们的同事进行了研究,以及他们面临的挑战,与医疗Xpress。欧宝娱乐地址“就髋细胞的再生医学中有效产生了患有髋细胞的血管基细胞而言,”Jain告诉Medical Xpress“,我们从先前建立的方法开始产生血管原性细胞,这些方法被证明为其他茎/祖氏来源工作欧宝娱乐地址细胞,例如人胚胎茎(HES)细胞。然而,根据IPS细胞,这些方法未能产生足够的血管原性细胞和/或证明在活的有机体内功能。此外,我们已经证明了不同IPS细胞系之间的显着变化 - 甚至在来自同一个人的克隆内。“简而言之,研究人员对血管前体的IPS细胞衍生IPS细胞的新技术突出了鉴定能够的血管原克隆的重要性形成耐用血管在活的有机体内。
Fukumura指出,另一个挑战是在血管发育过程中监测设计好的血管功能。他解释说:“迄今为止,大多数使用iPS衍生的内皮细胞或间充质细胞的小鼠模型都依赖于侵入性方法,如连续组织学切片来检查血管。”“这种方法不允许实时血管生成检查,需要大量的实验动物来评估任何动力学变化。”然而,研究人员已经证明了建立和使用最先进技术的记录在活的有机体内成像技术 - 复杂所谓的强大组合透明的窗口动物模型、目标细胞群和分子的遗传和药理标记、先进的光学成像设备(如本研究中使用的多光子激光扫描显微镜)和计算机辅助图像分析算法——为他们提供了长期、无创、活体小鼠iPS来源血管的功能评价。
而科学家们之前已经制造出了耐用的功能性血管在活的有机体内使用来自hES细胞的CD34阳性血管生成细胞1,此方法结果不适用于IPS细胞。因此,在目前的研究中,他们决定将其他血管原性标记物 - CD34(细胞表面糖蛋白介导干细胞直接向基质细胞附着),神经疏素素1(NP1)和人激酶纳入结构域受体(KDR) -已成功用于从HES细胞中衍生内皮细胞。“为了我们的知识,”撒母耳指出“,这是第一个报告,证明使用三重选择标记CD34,NP1和KDR用于分离血管原性前体细胞来自人类诱导的多能干细胞,最重要的是,在在活的有机体内设置”。
在目前的研究中,研究人员还开发了一种高效的2D培养体系,用于hiPS细胞来源的内皮前体细胞扩增。“我们之前已经证明,在内皮前体细胞扩张方面,2D培养系统比传统的3D培养系统更有效1指出:“耆那教的。“然而,目前尚不清楚2D培养体系是否对iPS细胞来源的细胞也更优越。因此,我们系统地比较了从hiPS细胞中生成内皮细胞的2D和3D培养方法,因为越来越多的证据表明,胚胎干细胞和iPS细胞不一定具有相同的行为方式。有趣的是,”他继续说,“我们发现3D培养系统产生了特征良好的内皮细胞在体外,源自IPS细胞的3D内皮细胞差异很差在活的有机体内。事实上,我们发现2D培养系统 - 类似于我们以前的衍生内皮细胞来自人胚胎细胞的内皮细胞的经验 - 能够与CD34,NP1和KDR三重标记选择一起生成小鼠的长期功能血管。“
耆那教点指出了产生内皮细胞或血管外细胞的几种方法在体外之前的报道,多种技术可以用于将iPS细胞分化为内皮细胞,而这些内皮细胞与iPS细胞具有可对比性在体外-但大多数植入动物体内后都不能持久。“在我们的研究之前,”Jain说,“突出的问题仍然是展示iPS衍生的血管功能,这可能是由于缺乏具有功能的血管源性细胞。在活的有机体内除了研究工程血管功能的方法论挑战之外。据我们所知,这项研究是第一个成功展示源自臀部细胞的持久血管的研究。“
Fukumura还指出,内皮细胞和间充质前体细胞对于建立稳定的血管系统都是至关重要的,而Edwin L. Steele实验室首次证明了这一点在活的有机体内他们之前使用人类脐内皮细胞(HUVECs)与小鼠胚胎干细胞共植入的工程构造创造了有功能的血管系统2。“这些船只持续了一年,或普通的动物生命跨度,在小鼠“Fukumura Readounts”的颅窗模型中。当前研究中的独特是在选择内皮细胞前体的源时使用侧面群MPCS。通过这种方式,我们可以使用与内皮细胞和MPC生成的相同的HIPS细胞 - 一种对未来临床应用来说非常重要的技术,因为它将减少在体外文化负担减半。”
Fukumura继续说,为了使未来的翻译潜力成为可能,成功形成持久血管所需的内皮细胞和间充质祖细胞类型必须来源于人类。“成人体细胞组织衍生的血管前体的增殖能力有限,”他解释说,“而使用来自人类胚胎干细胞的血管前体会引起伦理和免疫学方面的担忧,而使用ips衍生的血管源性细胞则可以避免这些担忧。”由于大多数血管生成细胞的动物研究都是在几周到几个月的时间内进行的,因此它们不能显示出使用这些程序所需的持久性和正常功能。“我们的目标是将这一时期延长到几个月,不仅是为了证明ips来源的血管前体的血管生成潜力,而且还为了证明工程血管的耐久性和功能性。”
关于这些无数的挑战,Samuel告诉医学快报,一种诱导成熟细胞多能性的方法的发现——即将细胞从分欧宝娱乐地址化状态带回干细胞样状态——为细胞再生医学领域带来了巨大的潜力。“然而,”她补充说,“从这些所谓的诱导多能干细胞(iPS)中获得功能性后代仍然是一个挑战。在这项研究中,我们证明了iPS细胞可以高效地生成血管前体细胞在体外这是vasculogenic在活的有机体内并且能够用健康和疾病(糖尿病)捐赠者的诱导多能干细胞制造出工程血管。”
塞缪尔进一步说明,一旦得到了基于IPS的蜂窝治疗的安全问题,这些结果提供了原则上,即自体(同一个体有机体是供体和受体)髋细胞衍生的血管前体可以用于在活的有机体内应用程序。“我们使用逆转录病毒和慢病毒技术来递送已知产生IPS细胞的转录因子的组合。此外,我们开发了来自健康对照和1型糖尿病患者的内皮和间充质祖细胞血管前体。”
然而,Jain解释说,为了在临床环境中使用,科学家们将需要使用非集成的重新编程方法;ips来源的血管前体必须进行详细的评估,以了解引入ips来源的血管前体时人类宿主的免疫反应;并且需要长期的随访以确保没有副作用。“我们已经证明,一旦优化,iPS衍生的血管是持久的在活的有机体内在老鼠中。这表明我们产生IPS衍生的血管的方法具有在需要血管疾病(如心血管疾病,长期缺血,动脉,糖尿病或非愈合溃疡的血管疾病)或血运重建的条件下在临床中翻译。
已经建立了一种从健康捐赠者的iPS细胞中生成血管的强大技术,研究人员接下来想要评估从1型糖尿病(T1D)患者中产生的iPS细胞生成的血管生成细胞的血管形成能力,这些患者发生了血管并发症。“我们的研究证实,来源于T1D-iPS细胞的内皮细胞和间充质前体细胞能够形成有功能的血管在活的有机体内,”Fukumura补充道。“此外,T1D-iPS细胞来源的血管在形态和功能上与ips来源的健康血管没有明显区别。”
展望未来,Fukumura描述了他们可能开发并应用于当前实验设计的其他创新:
- 使用非病毒、非集成的方法建立安全的iPS细胞生成协议,以确保零脚印技术
- 了解人类宿主对诱导多能性血管前体引入的免疫反应,并进行长期随访,以确保没有不良反应
- 了解在健康对照和患者特异性IPS细胞系中IPS细胞系分化变为血管后代变异性的因素
- 针对目标器官开发定制的内皮
- 建立大型动物模型的疾病,检查可能比小鼠更紧密地重新承载人类的IPS血管的影响
此外,塞缪尔概述了科学家们为他们的研究计划的下一步。她说:“我们将研究影响ips来源的血管前体形成血管潜能的机制。”“我们的计划是使用其他血管疾病患者特异性细胞系来衍生出血管子代,这将有助于理解疾病的病理生理学。”
耆那兴还看到了其他可能从他们的研究中受益的研究领域。“再生或修复血管的能力可能对血管疾病的治疗和血管损伤引起的其他条件进行关键差异,例如2型糖尿病患者的血管糖尿病并发症。此外,”他的结论是,“他结束了,”这些IPS衍生的血管原性细胞具有广泛的再生医学施用,因为血管对于最近在小鼠的功能性肝脏产生的任何功能器官中必不可少,具有共植入肝细胞,间充质茎细胞和血管内皮细胞。“
进一步探索
相关的
1来源于人类胚胎干细胞的内皮细胞形成了持久的血管在活的有机体内,自然生物技术317 - 318 (2007),doi: 10.1038 / nbt1287(PDF)
2组织工程:创造持久的血管,自然428, 138-139(2004年3月11日),doi: 10.1038 / 428138 a(PDF)
©2013医学欧宝娱乐地址快讯。保留所有权利。











用户评论