Lou Gehrig的疾病:从患者干细胞到一项研究中的潜在治疗策略
虽然该技术仅为几年,但科学家越来越多地利用“疾病”模型,以研究遗传,分子和细胞缺陷。但是,由Cedars-Sinai再生医学研究所的研究人员领导的医生和科学家团队在娄Gehrig病的研究中进一步进一步攻击脑和脊髓中肌肉控制神经细胞的致命紊乱。
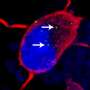
在利用创新的干细胞技术在具有疾病的患者的皮肤刮痧中产生神经元,研究人员插入了小延伸的遗传物质制成的分子,阻断了缺陷基因的破坏性效应,以及在过程中,为新的治疗战略提供“概念证明” - 将研究发现转化为临床试验的重要一步。
该研究,10月23日发布科学翻译医学被认为是首先,其中一种特定形式的Lou Gehrig疾病或肌萎缩侧面硬化剂被复制在一道菜中,分析和“治疗”,暗示了一项研究中的潜在未来治疗。
“从某种意义上说,这代表了我们试图通过基于患者的干细胞建模完成的全部频谱。它使研究人员有机会在翻译之前开展疾病的遗传和分子化的大量研究,并在实验室中发育潜在的治疗方法他们进入耐心审判,“罗德斯 - 西奈神经肌肉司兼神经病学系和多学科统计部主任的神经血清科师博士博士说。他是主导研究员和文章的高级作者。
使用诱导多能的最近发明的方法可以实现实验室疾病模型干细胞-细胞通过遗传操纵到胚胎状态来源于患者自己的皮肤样本和“及时送回”。从那里,它们可以制成人体的任何细胞。
该研究中使用的细胞由Cedars-Sinai的再生医学研究所的诱导多能干细胞核心设施产生。DHRUV SAREEN,博士学位,IPSC设施主任和博士学位,兼学院研究科学家与生物医学科学系,是文章第一作者和参加该研究的几位研究员之一。
“在这些研究中,我们转过了患者的皮肤细胞运动神经元保留了这种疾病的遗传缺陷,“Baloh说。”我们专注于两年前的C9ORF72,发现是家庭ALS最常见的原因圆颞叶片退化,甚至导致某些例外情况下的阿尔茨海默氏症和帕金森病。然而,我们需要知道的是缺陷如何引发疾病,所以我们可以找到一种方法来对待它。“
全颞叶片变性是一种脑障碍,通常导致痴呆症,有时会发生在串联中。
研究人员发现,C9ORF72的遗传缺陷可能导致疾病,因为它会改变来自基因的RNA结构,产生重复核苷酸的异常累积,RNA的基本组分。
“我们认为,通过改变运动神经元在运动神经元中的其他基因的正常行为,患者细胞核中的数千份重复序列GGGGCC的副本的积累可能变得”毒性“,”Baloh说。“因为我们的研究支持有毒的RNA机制理论,我们使用了两段遗传物质的遗传物质,称为反义寡核苷酸 - ASOS - 以阻断累积并降解毒性的RNA。一个ASO击倒整体C9ORF72水平。另一个撞击了毒性的RNA来自基因而不抑制整体基因表达水平。没有这种潜在的毒性RNA,并且没有对运动神经元有害作用的证据,为使用这种策略治疗患有这些疾病的患者提供了强有力的基础。“
来自另一个机构的研究人员最近导致了一个相似ASO策略的一期进行试验,以治疗由不同的基因突变引起的ALS,并据报道没有任何安全问题。
Clive Svendsen,博士学位,再生医学研究所和文章的作者之一,已经研究了一十多年。“Als可能是最残酷,最严重的神经系统疾病,但我认为这种合作努力中使用的干细胞方法占据了解锁这一和其他破坏性疾病的奥秘的关键。在再生医学研究所内,我们正在探索其他几个茎cell-based strategies in search of treatments and cures," he said, adding that ALS affects 30,000 to 50,000 people in the U.S., but unlike other neurodegenerative diseases, it is almost always fatal, usually within three to five years.
Svendsen最近收到了加州再生医学研究所获得了1780万美元的批准。本研究将与雪尔和雪叶和ALS临床团队合作,为ALS支持一种新的干细胞和生长因子治疗。





用户评论