可能的新制药靶点尤文氏肉瘤

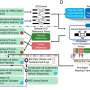
尤文氏肉瘤是一种恶性的儿科癌症,不当造成的最常见的基因与基因FLI1 EWS的融合。虽然早就知道原因,治疗这种融合的目标日期证明非常困难。科罗拉多大学癌症中心的一项研究中,最近发表在《华尔街日报》致癌基因从这种融合,下游发现其他链接在一系列事件导致癌症microRNA-22——这种融合了运动,调节另一个基因,KDM3A,这个信号链有助于确保EWS / FLI1融合的结果是癌症。研究人员认为,这些新目标可能更容易提供制药替代EWS / FLI1融合本身。
“我们最初的小分子核糖核酸从EWS / FLI1下游融合microRNA-22和缩小。但是我们看起来进一步下游从那里,发现microRNA-22通过另一个基因发挥作用,KDM3A,导致癌症。当我们拒绝了这个基因(KDM3A)在实验室研究中,我们观察到一个深刻的抑制尤因肉瘤细胞的致瘤的性质,”Paul Jedlicka说医学博士、铜癌症中心的调查员和病理学助理教授在科罗拉多大学医学院。
这项研究强调了复杂的级联事件,导致癌症。即使在看似“简单”癌症像尤因肉瘤与已知的致癌司机,致癌作用往往取决于致癌基因启动一连串的事件。换句话说,致癌基因可能坐在长,复杂的字符串的细胞事件,所有这些都需要引起癌症。
同样,基因并不是唯一级别之间的这一系列事件可以被打断——基因及其表达(潜在危险)蛋白质是所有转录的机制,包括化学物质的参与运输机械,使蛋白质的基因的信息(RNA)和化学物质决定基因的频率应该被制造成一种蛋白质(如微)。对这个复杂的级联的机制的理解,反过来,可以产生新的治疗靶点。
在这项研究中,Jedlicka和他的同事使用另一种形式的RNA叫shRNA静音KDM3A肿瘤促进基因的表达。但Jedlicka指出,一般来说,虽然成分在实验室是一个非常有用的工具,它的使用作为一种治疗剂是迄今为止有限。
“我们可以设计shRNA沉默几乎任何选择的基因,然后在细胞的研究中,我们使用一个细胞内病毒携带这种成分。这种方法有很多的挑战在人类,”Jedlicka说。
然而,由于KDM3A具有酶活性——它修改影响细胞的遗传物质基因表示,它可能有针对性的小分子抑制剂,目前结构类似于许多药物的使用。这类抑制剂理论上可以在药片,能够进入癌症细胞在那里他们可以抑制肿瘤的生长。重要的是,在模式生物基因研究表明,KDM3A不需要在大多数正常细胞,这是可能的,其目标是作为一个治疗耐受良好。
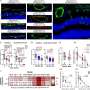
同时,Jedlicka和他的同事们展示一个强有力的理由KDM3A尤文氏肉瘤中作为一个新目标:他们证明人类样本基因过表达癌症,消耗的基因在patient-derived细胞株抑制肿瘤的生长,而损耗的基因在小鼠研究结果小鼠肿瘤生长的能力。
“事实上,其他癌症的早期数据显示,KDM3A可能是一个更常见的肿瘤促进剂。我们从尤文氏肉瘤可能应用在许多癌症。这非常令人兴奋,”Jedlicka说。
更多信息:www.ncbi.nlm.nih.gov pubmed / 24362521