FDA批准过程受到审查的研究
(每日健康)由美国食品和药物管理局批准并不意味着药物或医疗设备已收到的燃烧试验,证明安全毫无疑问地,根据三个新的研究评估机构的监管流程。
的研究,发表在1月22日的美国医学协会杂志》上发现,美国食品和药物管理局:
- 不适用同样的标准的证据通过临床试验,所有药物批准药物基于标准相差很大,通过案件。
- 通常批准现有心脏设备的升级版本,无需临床试验。
- 经常忽视了早期药物试验后造成重大问题延迟新的药物的批准。
这些研究是由于一个新的在FDA的开放精神,史蒂文·古德曼博士说:斯坦福大学的医学教授写了一篇相关的社论。
研究表明一个机构承受着巨大的压力从四面八方将药物市场快速但负责任的方式,他说。
“FDA走钢索,直到现在我们还没有大量的信息关于他们是如何做的平衡,”古德曼说。“他们正在使用的标准可能是完美的,他们是灵活的,允许创新,通过市场获得拯救生命的药物。另一边是他们可以决定过于急剧,允许有潜在危险的药物。这是一个困难的平衡,需要持续的监控。”
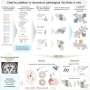
第一项研究中,涉及公开FDA文档的审核,发现了一个宽变化证据质量的机构使用批准的新药。
例如,大约三分之一的批准依靠证据获得从一个关键的审判,而最需要的两个或两个以上的关键试验来确认结果,作者约瑟夫·罗斯博士说:助理教授在耶鲁大学医学和公共卫生。
超过一半的试验药物正在审查安慰剂相比,但是毒品到另一个药物相比近三分之一。在大约一个批准10中,药物的性能没有与别的相比,研究人员指出。
临床试验也不同的大量的时间和规模,以及数量的人完成了试验和所使用的“终点”来判断药物的有效性。
“FDA他们说他们在做什么——它们对每个应用程序以不同的方式和他们应用不同的审批标准药物,”罗斯说。
这种灵活性可能正是需要适当的测试每一个新药,罗斯说,但是它让医生和病人不知道多少证据支持药物他们正在考虑批准。
“我们并不是说,FDA并不彻底,而不是严格的评估这些新药的批准,”他说。“但它应该清楚医生和病人,当药物被批准使用,有时我们知道很多关于它,有时我们知道更少。需要提供这些信息。”
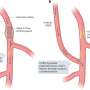
第二个《美国医学会杂志》研究发现,美国食品和药物管理局批准医生所使用的大多数移植心脏设备today-items起搏器和defibrillators-as已经更改模型,不需要新的临床数据的收集。
自1979年第一个设备获得批准,美国食品和药物管理局已批准5829变77设备,平均约50更改设备。超过三分之一的这些变化涉及到设备的设计或材料,在大多数的情况下,FDA认为新的临床数据没有必要的批准。
这个过程允许制造商轻松地更新设备,但可能导致潜在的致命缺陷的设备进入市场,作者说。
“关键心脏设备召回了在最近几年,这种圣裘德医疗套索,美敦力公司Sprint忠诚除颤器生源批准“适应现有设备,高级调查员Kesselheim亚伦博士的助理教授医学分部的药物经济学在布莱根妇女医院,在医院的新闻发布会上说。
第三个研究,由美国食品和药物管理局本身,看着科学机构和监管原因推迟或拒绝新的药物测试在2000年和2012年之间。
研究人员发现,延迟和否认由于设置问题常常导致正确的剂量,选择正确的病人包括试验中,或者建立适当的终点判断成功。
这些问题应该处理,避免浪费时间和金钱,伦纳德麻袋,FDA药物评价和中心
研究,和他的同事们得出结论。
“早期和频繁的对话FDA药品赞助商解决的关键方面研究设计(包括研究人群的选择,研究终点,与药物剂量)有可能减少航班延误在新药的批准,”他们写道。
更多信息:美国食品和药物管理局的解释道药物开发和批准过程。
论文:《美国医学会杂志》,DOI: 10.1001 / jama.2013.282034
编辑:doi: 10.1001 / jama.2013.283946
版权©2014每日健康。保留所有权利。