独特的蛋白质相互作用可能驱动帕金森氏症最常见的遗传原因
帕金森氏症最具破坏性的方面可能不是其使人衰弱的症状,这些症状会剥夺患者控制自身运动的能力。可能不是全世界数百万人及其家人每天遭受这种疾病的有害影响。事实上,它的根本原因可能在很大程度上仍然是个谜。但现在,格莱斯顿研究所(Gladstone Institutes)的科学家们已经发现,大脑中两种蛋白质之间的相互作用是如何促进脑细胞或神经元的退化和死亡的,从而导致帕金森氏症。这些发现与传统观念形成了鲜明的对比,为开发针对疾病难以捉摸的潜在机制的治疗方法奠定了急需的基础。
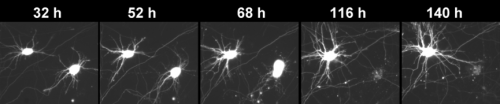
在最新一期的神经科学杂志,现在可以在网上看到,Gladstone研究员Steve Finkbeiner医学博士实验室的科学家们利用他们独一无二的机器人显微镜的能力,随着时间的推移跟踪单个神经元的寿命。显微镜已被用来研究各种各样的神经退行性疾病在这项研究中,他们把注意力集中在lrrk2上,lrrk2是帕金森氏症最常见的遗传原因。
科学家们早就知道,LRRK2的突变会导致错误折叠的LRRK2蛋白在神经元中积累。主流的假设是,错误折叠的LRRK2提高了一种叫做激酶的酶的活性,而这种激酶活性的提高是导致细胞死亡的原因。科学家们还发现,突变体LRRK2倾向于聚集在一起形成所谓的包涵体(IB),这是导致疾病进展的另一个因素。
因此,研究人员使用IB的存在和激酶活性的升高作为测量LRRK2的代理有害的影响芬克贝纳博士解释说,他是格莱斯顿神经学研究的副主任,也是格莱斯顿所在的加州大学旧金山分校的教授。“但我们不相信这些是细胞死亡的主要驱动因素,所以我们决定更仔细地观察细胞内部发生了什么。”
当研究神经退行性疾病(如帕金森症)时,传统的工具通常只允许研究人员追踪神经元的退化和死亡神经元死亡在人口层面。但芬克贝纳博士的革命性显微镜使研究人员能够跟踪成千上万个单个神经元的生活——为细胞生命周期中哪些事件在其死亡中起作用提供了最清晰的视角。
研究人员从两个来源获得了神经元:一是从LRRK2突变的转基因大鼠身上提取的神经元,二是从LRRK2相关帕金森患者的皮肤细胞中提取的人类神经元。然后他们随着时间的推移跟踪这些细胞,监测突变体LRRK2的积累以及这种积累是如何导致细胞死亡的。
“有趣的是,我们发现IB或激酶活性都不是导致神经元死亡的细胞毒性的直接原因,”Gladstone员工研究科学家Gaia Skibinski博士说,他是该论文的第一作者。“相反,细胞死亡的潜在原因似乎与弥漫突变体LRRK2的积累直接相关。”
但当研究团队更深入地观察这些动物的生活时神经元他们发现了一些有趣的东西:突变体LRRK2和阿尔法突触核蛋白(alpha-synuclein)之间的独特相互作用,阿尔法突触核蛋白是另一种长期以来被认为与帕金森症有关的蛋白质。研究表明,LRRK2突变的帕金森患者经常表现出α -突触核蛋白的异常积累。但直到现在,这两种蛋白质之间关系的确切性质仍不清楚。
“重要的是,我们发现在大鼠和人类细胞模型中,α -突触核蛋白的去除减少了细胞死亡是由突变体LRRK2引起的,”斯基宾斯基博士继续说道。“当我们进一步观察时,我们发现α -突触核蛋白的丢失导致LRRK2的立即下降。”
研究小组假设,在LRRK2突变患者中,α -突触核蛋白的积累阻碍了细胞清除LRRK2的能力,导致其积累。随着时间的推移,LRRK2的积累对细胞产生毒性,细胞死亡。
Finkbeiner博士说:“两种长期被认为在帕金森病中发挥作用的蛋白质之间的协同关系的发现,是朝着开发针对该疾病潜在机制的药物迈出的一大步。”“随着我们继续解开α -突触核蛋白和LRRK2之间精确的功能关系,我们正朝着阻止帕金森症对大脑的冲击的方向前进。”










用户评论