抑制前列腺癌的基因家族
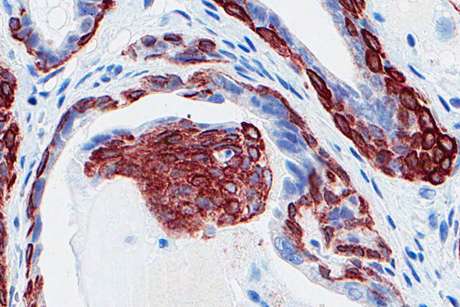
康奈尔大学的研究人员报告说,他们已经发现了直接的遗传证据,表明一个名为MicroRNA-34 (miR-34)的基因家族是真正的肿瘤抑制因子。
该研究发表在该杂志上细胞的报道, 3月13日。
之前在康奈尔和其他地方的研究表明,另一种名为p53,正向调控miR-34。半数的癌症都与p53突变有关。有趣的是,在许多癌症中,miR-34也经常被p53以外的机制沉默,包括那些患有p53基因突变。
研究人员在小鼠身上展示了p53和miR-34基因之间的相互作用如何共同抑制另一个基因癌症这种基因叫做MET。在p53和miR-34缺失的情况下,MET过表达一种受体蛋白并促进不受调控细胞生长和转移。
康奈尔大学生物医学科学系(Cornell's Department of Biomedical Sciences)的病理学教授、该论文的资深作者亚历山大·尼基廷(Alexander Nikitin)表示,这是这种机制首次在小鼠模型中被证明。Nikitin实验室的研究生Chieh-Yang Cheng是这篇论文的第一作者。
在2011年发表于《美国国家科学院院刊》(Proceedings of the National Academy of Sciences)的一篇论文中,Nikitin及其同事显示,p53和miR-34在细胞培养中共同调节MET,但目前尚不清楚是否同样的机制在癌症小鼠模型(一种用于研究人类疾病的特殊小鼠株)中起作用。
研究结果表明,靶向和抑制MET的药物治疗可能在p53和miR-34都不足的癌症中特别成功。
研究人员用培育的老鼠发育前列腺癌,然后灭活p53基因但仅在前列腺上皮组织中,因为这些基因的整体沉默可能会产生误导性的结果。
当miR-34基因在小鼠中单独沉默时,小鼠没有发生癌症。当p53自身被抑制时,在早期发展中就出现了癌前病变的迹象,但在15个月大时就没有癌症了。当miR-34和p53基因同时沉默时,研究人员在小鼠中观察到了完整的前列腺癌。
研究结果显示,“miR-34可以是一种抑癌基因,但它必须与p53一起工作,”Nikitin说。
在同时抑制miR-34和p53的小鼠中,癌性病变形成于前列腺管近端,位于已知的含有前列腺的腔室中干细胞。当p53单独被沉默时,早期病变发生在导管的远端,远离干细胞池所在的腔室。这表明p53和miR-34共同沉默可能与另一种机制有关。
此外,与对照组小鼠或只有miR-34或p53独立沉默的小鼠相比,p53和miR-34均沉默的小鼠的干细胞数量大幅增加。
Nikitin说:“这些结果表明,miR-34和p53共同调节前列腺干细胞隔间。”
他说,这很重要,因为癌症经常在干细胞不受控制和生长时发生。
研究者进一步发现p53和miR-34通过调控MET表达来影响干细胞的生长。在p53和miR-34缺失的情况下,MET过表达,这将导致前列腺干细胞的不受控制的生长和这些细胞中癌症的高水平老鼠。
未来的工作将进一步研究p53/miR-34/MET基因在干细胞生长和癌症中的作用。这些发现对许多类型的癌症都有影响。
进一步探索









用户评论