心脏瓣膜缺陷的遗传原因

心脏瓣膜缺陷是新生儿死亡的常见原因。德国波恩大学(University of Bonn)和凯撒研究中心(caesar research center)的科学家发现,“Creld1”是影响小鼠心脏瓣膜发育的关键基因。研究人员能够证明,在人类中发现的一种类似的Creld1基因通过与在老鼠中相同的信号通路发挥作用。这一发现是对心脏瓣膜缺陷发病机制的分子认识的重要一步。该研究结果已发表在该杂志上细胞发育。
房室间隔缺损(AVSD)是一种先天性心脏缺陷在这一心瓣膜和心间隔畸形。患有唐氏综合症的儿童尤其受影响。没有外科干预措施在美国,生命最初几个月的死亡率很高。波恩大学生命与医学科学(LIMES)研究所执行主任Michael Hoch教授说:“即使是在成年人中,仍有大约6%的心脏病患者存在未确认的瓣膜缺陷。”
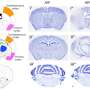
多年来,有迹象表明,所谓的Creld1基因(富含半胱氨酸的egf样结构域1)的变化增加了AVSD的致病风险。然而,这种基因和这种疾病之间的确切分子联系以前并不为人所知。来自LIMES研究所和位于波恩的凯撒研究中心的一个研究小组现在已经在小鼠模型中表明,Creld1在心脏发育中起着至关重要的作用。波恩大学的研究人员关闭了小鼠的Creld1基因:“我们发现心脏瓣膜和心脏间隔的前体细胞不能再正常发育,”来自LIMES研究所的Elvira Mass博士报告说。这是一个重要的迹象,表明Creld1在心脏发育的早期阶段是必需的。
在胚胎发育时,心脏是第一个器官
“在胚胎阶段,心脏发育成第一个器官。它通过血管系统泵血,并为身体其他器官提供氧气和营养,”合作伙伴Dagmar Wachten博士报告说。他在凯撒研究中心领导Minerva研究小组“分子生理学”,并从事心脏发育的研究。研究小组发现,Creld1基因控制着心脏瓣膜通过所谓的钙调神经磷酸酶NFAT信号通路。缺乏Creld1基因的小鼠心脏瓣膜缺陷最终导致机体氧气供应不足,导致小鼠胚胎在大约11天后停止发育。
改进诊断措施的潜在起点
研究小组预计,这些发现可以传递给患者。在心脏发育方面,小鼠和人类非常相似,Creld1基因和钙钙神经磷酸酶/NFAT信号通路在两种物种中同样具有类似的功能。“我们的结果有助于更好地理解心发展并且,在中期,改进对未查明的心脏瓣膜疾病的诊断,”Hoch教授解释说。有趣的是,钙调磷酸酶/ NFAT信号通路不仅活跃于心脏也活跃于免疫细胞中。在移植医学中,它必须长期被药物如环孢霉素A抑制,这样移植器官就不会产生排斥反应。“在免疫感觉卓越集群的范围内,我们目前正在研究Creld1在免疫细胞中的作用机制,”Hoch教授说,他相信它在未来的移植医学中也会很重要。
进一步探索







用户评论