钙在家族性阿尔茨海默病中的作用澄清,指向新的治疗方法
2008年,宾夕法尼亚大学佩尔布尔曼医学院的研究人员表明,两种蛋白质中的突变与家族性阿尔茨海默病(FAD)扰乱了神经元内钙离子的流动。两种蛋白质与细胞内隔室中的钙释放通道相互作用。这些蛋白质的突变形式导致FAD但不是正常蛋白质,导致细胞中夸大的钙信号传导。
现在,由J.Kevin Foskett,Phd,生理学椅子的领导,以及研究生,Dustin Shileding,发现了相同的团队发现,已经发现抑制了抑制了多动症钙通道在疾病的小鼠模型中缓解了类似的症状。他们的发现出现了本周神经科学杂志。
Alzheimer的当前疗法包括治疗认知丧失和痴呆症状的药物,以及解决Alzheimer病理学的药物是实验性的。这些新观察表明,基于调制的方法钙信号传导福斯克特说,可以探索。
两种蛋白质,称为PS1和PS2(PreseniLin1和2),与内质网中的钙释放通道,肌醇三磷酸受体(IP3R)相互作用。突变PS1和PS2增加IP3R的活动,反过来增加钙水平在细胞中。Foskett说:“我们开始回答这个问题:老年素前- ip3r相互作用导致的钙信号增加,是否参与了家族性阿尔茨海默病症状的发展,包括痴呆和认知缺陷?”“从这些实验的结果来看,答案是肯定的。”
强大的现象
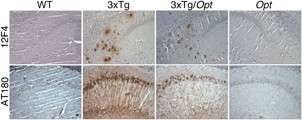
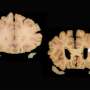
夸大的细胞内钙信号传导是在培养物和小鼠的人体细胞中表达突变突变突变素蛋白的细胞中看到的一种鲁棒现象。该团队使用了两个FAD鼠标模型来查找这些连接。具体而言,他们发现减少IP3R1的表达,大脑中该受体的显性形式,达到50%,在两种小鼠模型中归一化在皮质和海马的神经元中观察到的夸张钙信号。
此外,使用含有FAD突变的Presenilin 1的3xtg小鼠动物,以及表达突变体人Tau蛋白和App基因 - 该团队观察到IP3R1的表达降低,脑组织中的淀粉样蛋白斑块积累和高磷酸化Tau蛋白,Assiaval Alzheimer疾病的生化标志。由于行为测试测量,降低了IP3R1的表达也拯救了海马中的缺陷电信带,以及3XTG小鼠中的记忆缺陷。
“我们的结果表明,与家庭阿尔茨海默病患中的夸张钙信号传导与Presenilin突变有关,由IP3R介导,有助于动物的疾病症状,”Foskett说。“现在知道这一点,IP3信号传导途径可以被认为是患有与广告相关的预备金属突变患者的潜在治疗目标。”
'钙缺乏测定'假设
“钙的遗传性遗传学的”钙厌购“假设已经提出过Foskett实验室的研究结果。阿尔茨海默病影响了多达500万美国人,其中5%的家庭形式。标志该疾病是大脑中淀粉样蛋白β蛋白的缠结和斑块的积累。
“淀粉样蛋白假设”,假设初步缺陷是大脑中有毒淀粉样蛋白的积累,长期以来一直用于解释阿尔茨海默氏症的原因“,Foskett说。在实验室的2008年神经元研究中,携带疾病突变形式的PS1的细胞显示出淀粉样蛋白β的加工依赖于PS蛋白与IP3R的相互作用。该观察结果与淀粉样蛋白的产生,在淀粉样蛋白的产生中,在淀粉样蛋白的血管中的特征中的表现,具有阿尔茨海默病的脑中的特征。
AD的临床试验在很大程度上是为了减少大脑中的淀粉样蛋白负担。Foskett说,到目前为止,这些试验还没有证明有治疗效果。一种观点是,干预在疾病过程中开始得太晚。因此,针对无症状FAD患者的抗淀粉样蛋白临床试验正在进行中,因为人们知道他们最终会发展成这种疾病,而预测谁会发展成常见形式的AD则不太确定。
Foskett说:“过去有一种假设,FAD就是简单的AD,发病时间更早,发病更剧烈。”“然而,我们不知道FAD的病理病因是否与普通AD相同。因此,我们的发现与理解普通AD的相关性并不清楚。在我看来,重要的是要认识到AD可能是一系列会导致常见晚期病理的疾病。因此,FAD可能被认为是一种孤儿病,找到有效的治疗方法是很重要的,特别是针对这些患者-靶向IP3R和钙信号。”
进一步探索









用户评论