开启干细胞利基
多年来,科学家一直在试图解析导游功能和血液干细胞的分化,这些细胞产生包括我们免疫系统的所有血细胞。对人血液干细胞的研究很困难,因为它们只能在专门的“德基斯”中的骨髓中发现,不能在培养皿中重新核发。
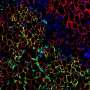
现在,在干细胞研究员Claudia Waskow教授(Technische Universität Dresden)的带领下,来自德累斯顿的一组科学家能够生成支持人体移植的老鼠模型造血干细胞尽管物种障碍,但无需照射。它们使用小鼠干细胞中试剂盒受体的突变,以促进人细胞的植入。在新的模型中,人血液干细胞可以扩张并分化为血液的所有细胞类型而无需任何额外的处理。甚至可以在该小鼠中有效地产生通常不能在“人源化”小鼠中的先天免疫系统的细胞。重要性是与先前现有的小鼠模型相比,干细胞可以在较长时间内保持在小鼠中。这些结果现已在着名的期刊上发表“细胞干细胞“。
“我们的目标是为移植和人类血液干细胞的研究开发一个最佳模型,”Claudia Waskow说,她最近担任了德累斯顿工业大学医学院“动物造血模型”的教授。此前,Waskow教授是德累斯顿再生治疗中心(DFG-Center for Regenerative Therapies Dresden)的小组领导,该中心进行了大部分的研究。
Claudia Waskow的团队使用的实现最佳干细胞移植的技巧是将Kit受体的自然突变引入缺乏功能免疫系统的小鼠中。通过这种方法,他们避开了血液干细胞移植的两个主要障碍:受体免疫系统的排斥和受体骨髓中流入的供体干细胞缺乏自由的生态位空间。空间通常由照射治疗提供,称为条件反射,因为它破坏和耗尽内源性干细胞,从而为进入的人体细胞腾出空间。然而,辐射对许多类型的细胞都有毒性,并可导致强烈的副作用。新的小鼠模型中的Kit突变损害了受体的干细胞室,这样内源性血液干细胞可以很容易地被具有功能Kit受体的人类供体干细胞取代。这种替代的工作效率如此之高,以至于可以完全省略照射,允许在生理条件下研究人类血液的发展。这个模型现在可以用来研究人类血液疾病免疫系统或测试新的治疗方案。
Waskow小组教授的结果还表明,套件受体对功能很重要人类血液干细胞,特别是在移植环境中。进一步的研究将集中在利用这些关于受体的作用的知识来改善治疗环境中的调节治疗造血干细胞移植的病人。











用户评论