将人体IPS细胞衍生的富含神经血管祖细胞移植到ALS模型小鼠中延伸了它们的寿命
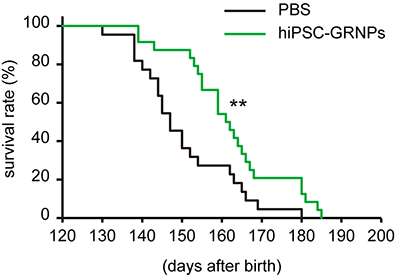
由IPS细胞研究和应用(Cira)中心教授Haruhisa Inoue博士领导的研究小组,京都大学和研究员Takayuki Kondo博士发现了人类IPS细胞衍生的神经血管祖的移植细胞进入肌营养的外侧硬化(ALS)模型小鼠延长了他们的寿命。
众所周知,小鼠和人类胎儿的移植得出神经祖细胞进入SOD1基因突变诱导的ALS模型小鼠延迟变性运动神经元和病理进展。为了将其应用于临床病例,有必要与人体细胞进行研究,这些研究可以不断供应。
Inoue的群体建立了富含神经神经血管祖细胞的分化协议,其是来自人IPS细胞的神经元前体,从人IPS细胞移植到ALS模型小鼠的腰脐带中。将移植细胞分化为星形胶质细胞,与移植物的小鼠的存活时间与没有移植物的那些相比延伸。还建议移植的细胞通过增加神经营养因子来改善脊髓环境。这些研究结果表明使用人IPS细胞治疗细胞移植患者的可能性。
ALS是一种进步疾病,其中运动神经元变得功能失调,肌肉变得无法移动。对ALS的治疗的研究大致分为2个策略。一个是再现ALS的病理和寻找治疗药物以改善它。另一种是通过细胞移植失去其功能以适当刺激肌肉的功能的互补和再生。研发后一项策略,研究小组报告说,在某种程度上通过移植人IPS细胞衍生的神经神经网络的移植可以在一定程度上预期治疗效果,包括延长存活时间。祖细胞(HIPSC-GRNPS),其中许多在移植后分化为星形胶质细胞。
神经营养因子在ALS的病理学中是重要的,并且在全球范围内调查作为治疗的目标。Inoue的研究表明,神经营养因子随着细胞移植治疗且Als模型小鼠中的脊髓环境得到改善。
胶质谱系的细胞具有制备神经细胞周围环境的功能。假设健康的运动神经元是开花植物,胶质谱系的细胞发挥了鲜花所需的土壤供应营养的作用。然而,难以补充植物,即再生丢失的运动神经元。在这项研究中,该团队通过补充良好的土壤,这是人类IPS细胞衍生的神经血管祖细胞。为了再生患病的运动神经元,不仅需要提供良好的土壤,而且还需要自己提供良好的土壤。将来,健康运动神经元的移植可能会更有效地恢复该功能,但仍有许多问题仍有待克服,并且在达到研究人类治疗效果的阶段之前需要大量的时间。
进一步探索











用户评论