结直肠癌的研究提供了洞察细胞生物学
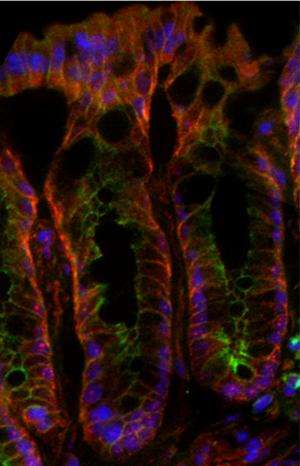
最近的一项研究发表在杂志上致癌作用由堪萨斯大学的研究人员展示了一个新角色的蛋白腺瘤息肉病杆菌(APC)抑制结肠直肠癌症元凶成为造成癌症相关死亡的在美国
克丽丝蒂第一作者这本书,分子生物科学学系的副教授,也是癌症生物学项目的KU癌症中心,度过了自己职业生涯的时间试图了解APC的各种活动,一种蛋白质的功能被认为启动大约80%的损失结肠息肉结肠癌的前兆。这本书,连同她的博士后法师Zeineldin,本科生马修•米勒和兽医病理学家鲁思•沙利文现在报道,APC在特定亚细胞中发现的隔间里,从炎症以及肿瘤细胞核,保护开发与慢性结肠炎。
APC到达细胞核是否可能影响的能力肠道干细胞与专业产生分化细胞功能,这本书说。
“这不是广泛赞赏,但仍有大量的细胞生长在成年人,结肠癌是一个很好的例子,”她说。“平均,我们摆脱和替换每年约70英镑的肠组织,所以你可以想象,这一过程需要精致的控制,防止肿瘤形成。”
定期更新的结肠粘膜发生通过干细胞不断分裂的能力。这些细胞产生后代,占用特定的角色:通过分泌粘蛋白,例如,杯状细胞产生一层粘液,作为结肠对许多微生物租户的物理屏障。但如果APC找不到细胞核,这本书和她的团队注意到更少的杯状细胞作为一个结果。
“我们引入了一个特定的APC突变成老鼠拿走核邮编,可以说,离开APC困在细胞质中,“这本书说。研究人员研究了这只老鼠模型条件下,诱发溃疡性结肠炎,炎症性肠病的一种形式,可以是一个前奏结肠癌。
观察更多在这些小鼠结肠肿瘤与正常相比APC在相同的疾病,他们推测,功能性核APC可以防止炎症及其下游的影响,包括肿瘤的发展。现在,这本书认为她和她的团队可能的线索这是如何发生的。
“杯状细胞数量的下降,我们观察到的是惊人的,”她说。”然后我们检查的一个蛋白质中发现粘液,称为Muc2,并发现它的RNA水平大大降低。如果有更少的杯状细胞APC的结果无法达到细胞核,也会有更少的粘液,这可能增加结肠癌的敏感细菌和其他微生物在肠道,促进炎症的能力。”
Neufeld医生说,虽然仍然没有快速修复突变基因,也许可以开发工具综合取代那些厚厚的黏液层在受影响的人们。
APC的一个已知函数是它停止细胞增殖:通过内容加以规范化的Wnt信号通路,否则指示细胞出去和繁殖。这本书和她的小组已经表明,使用相同的小鼠模型,APC驻扎在细胞核是必要抑制Wnt及其信号伙伴们遭受到打击β-catenin,正常APC的一个关键目标。与核APC控制杯状细胞分化的作用现在支持,研究人员正在调查可能的机制学习如果和Wnt通路成员如何参与其中。
由2843个氨基酸,APC是一个大型的蛋白质。
”而不是一个简单的、单一功能的蛋白质,APC更像是一组复杂的移动部件,每个做一些不同的和大多数仍然知之甚少,“这本书说。“我认为如果这种蛋白质的唯一目的是为了目标β-catenin破坏,它不会需要这么大。我们下一步的工作是找出如何杯状细胞分化是由一个或多个控制APC的许多组件”。
一系列机械的细节之外,更大的图景,这本书和她的小组将继续探索是一些炎症反应可以产生出结肠癌细菌的渗透比普通人的细黏液层在肠道,导致有缺陷的APC。只是什么APC的可能性,不做什么,以及如何弥补任何肠道相关故障APC的损失函数,提出一个具有挑战性的谜也为科学家喜欢这本书收获丰富的收获。
进一步探索