研究提出了杀灭结核杆菌的新策略
在过去的几年里,一类被称为ADEPs(环酰基脱肽)的化合物已经成为对抗耐药细菌的一种有前途的新武器。这种化合物通过与一种叫做ClpP的细胞酶结合而起作用,细菌细胞利用这种酶来清除有害蛋白质。当附着ADEP时,ClpP就不能正常工作,细菌细胞就会死亡。
现在,来自布朗大学和麻省理工学院的科学家们展示了ADEPs如何与导致结核病的细菌中的ClpP复合物结合的新细节。研究人员希望这项发表在美国国家科学院院刊,可以作为优化ADEPs治疗结核病的蓝图。
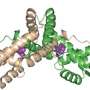
布朗大学化学副教授、这项新研究的合著者杰森·塞洛(Jason Sello)将ClpP称为“细胞垃圾处理机”。ClpP复合物是一种桶状分子,可以吞噬和降解可能漂浮在细胞内的任何有害蛋白质。ClpP与一组伙伴蛋白一起工作,其中包括一种叫做ClpX的蛋白质。ClpX收集不需要的蛋白质,在ClpP桶上打开一个洞,并将不需要的蛋白质输送进去降解。
adep被认为是通过冒充ClpX模拟物来破坏这一过程。作为冒名顶替者,adep与ClpP结合的位置与ClpX正常情况下的位置相同。与ADEP结合后,ClpP会肆意吞噬健康的蛋白质,最终摧毁细胞。正是通过这一过程,实验室实验显示,ADEPs可以杀死几种有害细菌,包括金黄色葡萄球菌和肺炎链球菌。
然而,这些化合物并没有那么有效结核分枝杆菌Sello和他的同事们想找出其中的原因。一种可能的解释是Mtb中的ClpP复合物比其他细菌中的ClpP复合物要复杂得多。
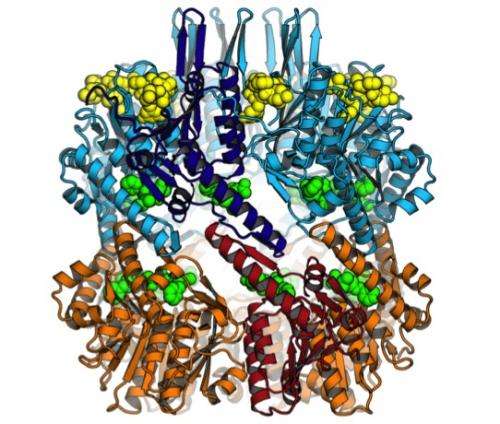
在大多数细菌中,ClpP桶是由14个单一蛋白质副本组成。但在Mtb中,它由两种不同蛋白质的七个副本组成,称为ClpP1和ClpP2。更重要的是,之前的研究表明,ClpP1和ClpP2只有在ClpX这样的伙伴以及注定要被ClpP破坏的蛋白质存在的情况下才能形成活性复合体。
“抵抗结核分枝杆菌deps及其ClpP的特殊性引起了我们的好奇心,”塞洛说,他与罗伯特·绍尔(Robert Sauer)领导的麻省理工学院生物化学家团队一起进行了这项研究。“我们想确定adep是否能像在其他细菌中那样结合并扰乱结构和功能。”
为了做到这一点,研究人员将Mtb中的两种ClpP蛋白混合在试管中。然后,他们添加了adps作为ClpX的模拟物,并添加了一种称为肽激动剂的化合物来模拟a蛋白质被降级。正如他们所希望的那样,研究人员表明,这种混合物确实产生了一种活性ClpP复合物,能够降解多肽和蛋白质。
塞洛说,这本身就是一个有趣的发现。这证实了一个观点,即adep能够模拟ClpX并诱导ClpP1、ClpP2和激动剂聚集在一起形成高度活跃的ClpP复合物。他们还发现,在Sello的实验室合成并用于实验的新型ADEP类似物,在结合和激活ClpP方面比以前报道的那些更好。
Sello说:“从药物发现的角度来看,这些结果很重要,因为它们表明,adep可以像影响其他细菌一样影响结核分枝杆菌中ClpP的功能,而且adep的效力可以提高。”
在此基础上,研究人员进一步进行了研究。他们使用x射线晶体学在原子分辨率上分析了优化的ADEPs与Mtb ClpP的结合。研究小组惊讶地发现,ADEPs只与复合物中的ClpP2蛋白结合,而不与ClpP1蛋白结合。塞洛说,这可能是adep对结核病没有那么有效的原因。
“幸运的是,这种结构为设计更好地与ClpP结合的adep提供了策略,”Sello说。“我们已经产生了许多关于如何合理修改ADEP结构以改善ClpP结合从而杀死ClpP的新想法结核分枝杆菌.我们非常乐观地认为,我们的一些设计最终可以成为一种新的药物,用于治疗肺结核."
塞洛和他的团队已经开始实验,看看他们的新想法是否可行。该小组希望,这种与ClpP结合的ADEPs的详细情况将继续揭示对抗结核病的新方法。
更多信息:结核分枝杆菌ClpP1P2的晶体结构提示了一种由AAA+伙伴结合和底物传递激活肽酶的模型,PNAS,www.pnas.org/cgi/doi/10.1073/pnas.1417120111