康奈尔大学的化学家证明渐冻症是一种蛋白质聚集性疾病
康奈尔大学(Cornell University)的化学研究人员利用一种技术,揭示了单个蛋白质的细微变化,为肌萎缩性脊髓侧索硬化症(ALS)的潜在病因提供了新的见解。
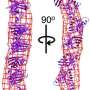
化学和化学生物学教授布莱恩·克兰(Brian Crane)领导了一项研究,并参与撰写了一项后续的光谱方法,该方法可以检测溶液中含铜蛋白质的细微变化。他和杰克·弗里德教授物理化学他们与康奈尔大学国家生物医学中心高级ESR技术副主任Petr Borbat共同开发了这种方法。
第一个证明了该技术原理的研究——脉冲偶极电子自旋共振(ESR)光谱学——在10月7日发表生物物理期刊;第二篇论文是与斯克里普斯研究所(the Scripps Research Institute)的合作者共同撰写的,在10月14日发表于《科学》杂志(science)上美国国家科学院院刊《美国科学院学报》(PNAS)。
肌萎缩性侧索硬化症是一种复杂的神经退行性疾病,它通常有遗传成分——导致它可以遗传的遗传缺陷。科学家们早就知道,其中一个罪魁祸首基因编码蛋白质“超氧化物歧化酶1”或SOD1,这是一种关键的含铜酶,通过破坏自由基来保护细胞免受氧化损伤。
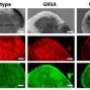
克莱恩说,科学家已经推测,肌萎缩性侧索硬化症是一种与神经元氧化损伤有关的疾病,这可能仍然是正确的。但他和同事们为另一种假说提供了强有力的证据:SOD1突变通过破坏SOD1蛋白结构导致ALS。这导致蛋白质的运动增加,Crane将其比作“呼吸”。这一运动促进了它们的聚集,或聚集在一起——这是对健康细胞有毒的事件。
克莱恩说:“这种形式的肌萎缩性侧索硬化症似乎是一种蛋白质聚集性疾病,很像老年痴呆症和帕金森氏症。”
长期以来,人们一直在研究SOD1的突变,试图了解ALS,但发现正常蛋白和突变蛋白的性质非常相似。通过使用ESR光谱学,科学家们第一次看到了明确的差异。克兰说,通过其他方法的验证,研究人员发现,突变极大地改变了蛋白质的动态,并显示出聚集的趋势。
在PNAS在论文中,还利用x射线散射研究了蛋白质的结构变化和相互作用的能力。研究人员发现蛋白质聚集与肌萎缩侧索硬化症症状的严重程度相关
克莱恩说,他们的结论指出,肌萎缩性脊髓侧索硬化症可能更多地与聚集毒性有关,而可能与突变对SOD1活性的影响较少有关。肌萎缩性侧索硬化症是一种迟发性疾病,患者通常处于中晚期。他说:“SOD1的散发性突变来自自然过程,但并不真的清楚它们是否真的会产生疾病。”





用户评论