科学家认为渐冻症的发展与蛋白质不稳定性的增加有关
来自斯克里普斯研究所(TSRI)、劳伦斯伯克利国家实验室(伯克利实验室)和其他机构的科学家们的一项新研究表明,肌萎缩性侧索硬化症(ALS)也被称为卢伽雷氏病。
“我们的工作支持一个共同的主题,即蛋白质稳定性的丧失会导致疾病,”TSRI的结构生物学教授、伯克利实验室的高级科学家John a . Tainer说,他与TSRI教授Elizabeth Getzoff共同拥有这项新研究的高级作者身份。
Getzoff, Tainer和他们的同事,专注于突变对编码超氧化物歧化酶(SOD)蛋白质的基因的影响,在本周的在线早期版上报告了他们的发现美国国家科学院院刊.这项研究提供的证据表明,那些与更严重的疾病形式有关的蛋白质在结构上不太稳定,更容易形成群集或聚集。
“这里的建议是,稳定SOD蛋白的策略可能有助于治疗或预防SOD相关的ALS,”Getzoff说。
在风华正茂时出风头
肌萎缩性脊髓侧索硬化症(ALS)因其能在壮年时期使人死亡而臭名昭著。1941年,棒球明星卢·格里克(Lou Gehrig)死于这种疾病,年仅38岁,首次进入公众意识。最近,ALS协会的冰桶挑战提高了公众对该疾病的认识。
肌萎缩性脊髓侧索硬化症通过破坏控制肌肉的神经元(最终包括控制呼吸的神经元)来致死。根据美国疾病控制与预防中心(Centers for disease Control and Prevention)的新数据,在任何时候,大约有1万名美国人患有这种疾病,但它几乎总是在症状出现后的几年内致命。
SOD1突变是肌萎缩性侧索硬化症中被研究最多的因素,大约四分之一的遗传性肌萎缩性侧索硬化症病例和7%的普通“散发性”肌萎缩性侧索硬化症病例中都有这种突变。sod相关的ALS有近200个变体,每个变体都与一个不同的SOD1突变相关。然而,对于几十种不同的SOD1突变是如何导致同一种疾病的,科学家们仍然没有达成一致。
与sod1相连的ALS的一个共同特征是受影响的运动神经元及其支持细胞中出现SOD簇或聚集物。在受影响的细胞中也发现了SOD与其他蛋白质的聚集物,即使在与SOD1突变无关的ALS病例中也是如此。
2003年,基于Tainer、Getzoff等人对SOD突变蛋白的研究,他们提出了“框架失稳”假说。从这个角度来看,als连接的突变SOD1基因都编码了结构不稳定的SOD蛋白形式。不可避免地,这些不稳定的SOD蛋白中的一些失去了正常的折叠,暴露出通常隐藏的粘性元素,它们开始相互聚集,速度比神经元清理系统的速度还要快——SOD聚集的积累以某种方式引发疾病。
结块越快,疾病越严重
在这项新研究中,Tainer和Getzoff实验室及其合作者使用先进的生物物理方法来探测特定遗传ALS“热点”中不同的SOD1基因突变如何影响SOD蛋白的稳定性。
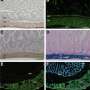
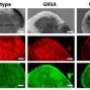
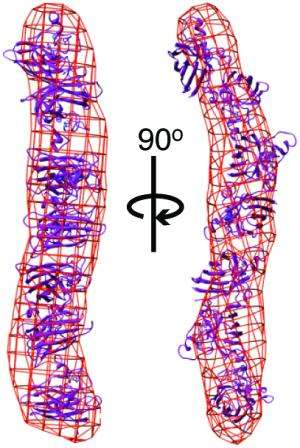
首先,他们研究了被称为SOD G93A的最被研究的突变型SOD与非突变型“野生型”SOD的聚集动态有何不同。为了做到这一点,他们开发了一种逐渐诱导SOD聚集的方法,用一种名为SAXS(小角度x射线散射)的创新结构成像系统在伯克利实验室的高级光源的SIBYLS光束线上测量。
“甚至在我们加速聚合过程之前,我们就可以检测到两种蛋白质之间的差异,”大卫·s·申说,他是伯克利实验室和TSRI泰纳实验室的研究科学家,他在伯克利继续研究SOD的结构。
G93A SOD比野生型SOD聚集得更快,但比一种名为A4V的SOD突变体聚集得更慢,而A4V与一种进展更快的ALS相关。
随后对G93A和其他5个G93突变体(其中蛋白质93位的氨基酸甘氨酸被不同的氨基酸取代)的实验表明,与野生型SOD的紧凑折叠结构相比,突变体形成了长而杆状的聚集物。快速形成更长的聚集体的突变SOD蛋白同样与快速发展的ALS相对应。
如何解释这些SOD突变体的稳定性下降?进一步的测试集中在铜离子的作用上,铜离子通常被纳入SOD结构,并有助于稳定蛋白质。使用另外两种技术,电子自旋共振(ESR)光谱和电感耦合等离子体质谱(ICP-MS),研究人员发现g93突变的SOD吸收铜离子的能力似乎正常,但在轻度应激条件下保留铜的能力下降,而且这种能力在与更严重的ALS相关的SOD突变体中更低。
“有迹象表明,突变型SOD比野生型SOD更灵活,我们认为这解释了它们相对无法保留铜离子的原因,”该研究的第一作者阿什利·j·普拉特(Ashley J. Pratt)说,他是Getzoff实验室的学生,也是伯克利实验室Tainer的博士后。
走向新疗法
简而言之,g93突变体的sod似乎具有更松散、更柔软的结构,更容易脱落铜离子,因此更容易错误折叠并聚集在一起。
与该领域的其他研究人员一起,Getzoff和Tainer怀疑突变SOD的异常相互作用引发炎症,破坏普通的蛋白质运输和处理系统,应激并最终杀死受影响的神经元。
“因为突变的sod更容易变形,”Getzoff说,“它们不能正确地保持和释放它们的蛋白质伙伴。通过确定这些有缺陷的伙伴关系,我们可以为开发治疗ALS的药物提供新的目标。”
研究人员还计划确认其他SOD突变体的结构稳定性和ALS严重程度之间的关系。
“如果我们的假设是正确的,”Shin说,“未来治疗sod相关肌萎缩性侧索硬化症的疗法不需要针对每个个体的突变,而是应该适用于所有的突变。”
ESR实验在康奈尔大学Brian Crane和Jack H. Freed的实验室进行,ICP-MS实验在佐治亚大学Michael W.W. Adams的实验室进行。
进一步探索