酶的改变自我帮助激活免疫系统
已知减少蛋白质,酶SPPL3原来有更多的人才,根据约翰霍普金斯大学的一项新的研究。在其新发现的角色,SPPL3作品没有切割蛋白质激活T细胞,免疫系统的步兵。因为它的结构类似于presenilin酶,已与阿尔茨海默病,研究人员认为他们的发现可以解释presenilin功能,除了提供新的见解免疫系统是如何被控制的。
总结他们的研究结果发表在12月22日,2014年的《华尔街日报》分子和细胞生物学。
“没有人可以预测SSPL3参与T细胞的激活,”乔尔Pomerantz说,博士,副教授约翰霍普金斯大学生物化学。“这走起来像鸭子,叫起来也像鸭子,但是它可以像鸭子那样插入浅水湾或者岸边能力不发挥作用。”
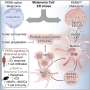
T细胞是免疫系统细胞杀死入侵细胞,帮助激活免疫细胞。当一个外国蛋白质结合T细胞受体蛋白质在外面,一个信号中继系统被激活。完成当叫做NFAT的蛋白质转移到细胞核,在许多基因完全准备战斗的T细胞。一些之间发生了什么,但Pomerantz和他的团队想要在这个过程中找到更多的球员。
研究人员寻找蛋白质,可以增加NFAT的活动,发现SPPL3,证明NFAT的关键酶的激活,但从未涉及免疫系统功能。进一步测试正确放置SPPL3序列内的事件,导致NFAT激活。
SPPL3住在内质网(ER)的膜,折边,膜结合细胞内舱,帮助过程新的蛋白质,它似乎鼓励STIM1和Orai1之间的相互作用,两个已知NFAT信号中继系统的组件。但SPPL3完成这个不使用它的酶,或蛋白切割能力。它也鼓励释放的钙,导致信号系统,尽管目前尚不清楚这是它直接或间接地。
“SPPL3是一个相对无特征的蛋白质,从未涉及免疫系统功能”,Pomerantz说。“它打开了一个全新的科学问题。”
Pomerantz认为SPPL3可以用作药物目标增强T细胞的活化免疫缺陷个体或者抑制过度活跃的免疫系统。他还计划研究的能力SPPL3调解的涌入到细胞内钙和钙的释放,因为钙是不可或缺的功能很多细胞信号网络。
进一步探索