FDA批准旨在缓解中风风险的新设备
(Healthday) - 该机构周一宣布,一项旨在降低某些患者中风风险的新技术已获得美国食品药品监督管理局的批准。
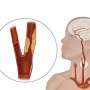
该机构解释说,ENROUTE的经碳纤维化神经保护系统(TNS)是第一个旨在通过颈部的切口而不是腹股沟进入颈动脉(颈部)动脉的设备。
该系统被批准用于正在接受程序以恢复窄颈动脉正常血流的人。
该系统还具有“血流逆转系统”,以捕获在血管成形术和支架上脱落的动脉中的堵塞部分。
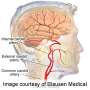
颈动脉向大脑提供血液,但可以通过称为斑块的胆固醇或脂肪物质的积累来缩小或阻塞。如果一块斑块破裂,它可以传播到大脑并引起中风。
根据国家心脏,肺部和血液研究所的说法,颈动脉疾病在美国导致一半以上的中风。
威廉博士解释说:“直到今天的清除,唯一捕获和清除碎屑并防止其在颈动脉血管成形术和支架过程中捕获和消除碎屑的系统需要通过腹股沟切口进入股动脉进入身体。”Maisel在FDA新闻稿中。他是FDA设备和放射健康中心设备评估办公室的代理主任。
他说,新系统的目的是适合那些不扭曲或“曲折”船只“允许通过腹股沟进入狭窄的颈动脉”的患者。
一位专家称赞FDA批准。
纽约州北岸大学医院神经病学主席保罗·赖特(Paul Wright)博士说:“这是一种'清理'有害牌匾的新方法,'清理'有害牌匾。”
他解释说:“到目前为止,唯一可用的选择是颈动脉支架和开放手术。”“颈动脉支架涉及进入腹股沟并一直前往斑块地点。”
在新系统中,Enroute设备“通过堵塞上方的小切口进入脖子,然后放置支架,”赖特说,他也在纽约州新海德公园的长岛犹太医疗中心。斑块被过滤在身体外。这种新颖的方法为患者提供了另一种可靠的方法,可以安全地“清理”潜在的有害牌匾。”
FDA在加利福尼亚州Silk Road Medical制造的FDA批准基于该公司支付的临床试验结果。研究发现,接受该系统治疗的患者的中风,心脏病发作和死亡的速度仅为3.5%,表现优于该研究的目标目标11%。
然而,该研究发现,大约14%的患者发生了至少一种严重的并发症。其中包括在插入装置的部位过多的出血或损伤,低血压以及在颈动脉中放置后支架内血块的形成。
FDA指出,ENROUTE的并发症的速率和类型与其他与其他颈动脉手术相关的并发症相似。
进一步探索
版权所有©2015健康日。版权所有。