Farydak批准用于多发性骨髓瘤
(每日健康)-Farydak (panobinostat)已经被美国食品和药物管理局批准用于治疗多发性骨髓瘤,患血液癌症的风险。
影响主要是老年人,疾病导致血浆细胞大量繁殖,超越其他健康的血细胞骨髓。这可以削弱免疫系统,导致骨骼和肾脏问题,FDA在一个新闻发布会上说。
多发性骨髓瘤诊断每年近22000人,每年造成约10700人死亡,根据美国国家癌症研究所。
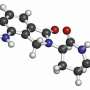
Farydak抑制酶称为组蛋白去乙酰酶抑制剂(hdac),它可以缓慢的生产过剩浆细胞在多发性骨髓瘤患者中,FDA说。
新药批准之前的人收到了至少两个标准疗法。是通过给定的结合两个其他药物,bortezomib和地塞米松。
去年11月,美国食品及药物管理局顾问委员会建议对批准Farydak复发多发性骨髓瘤患者,说它的好处不超过其风险。但是药物的制造商,诺华,随后提交额外的信息支持药物用于多发性骨髓瘤患者谁收到了至少两个标准疗法之前,FDA说。
的安全性和有效性Farydak结合bortezomib和地塞米松评估在临床研究涉及193人多发性骨髓瘤。收到当天的人看到一个延迟疾病进展约10.6个月,而5.8个月收到了其他两种药物的人群中孤独。
Farydak的标签包括一个潜在的致命的黑框警告或严重的心脏病,严重腹泻,FDA说。
更常见的和不太严重的反应可能包括腹泻、疲劳、恶心、四肢肿胀、食欲不振、发热、呕吐和弱点。
诺华公司总部设在东汉诺威,新泽西州
更多信息:FDA更多有关这个批准。
版权©2015每日健康。保留所有权利。