FDA请求停止销售压力植入物
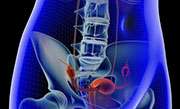
拜耳公司向美国食品和药物管理局提交的一份公民请愿书称,拜耳公司的避孕植入物“压力”可能会导致严重的并发症,应该撤出市场。
大约13年前,FDA通过了快速审查程序,批准了Essure,因为对于不想要更多孩子的妇女来说,该设备是手术绝育的第一种选择,可以让患者快速恢复,纽约时报报道。
然而,自从批准了Essure后,FDA已经收到了4000多份严重并发症的报告,包括严重的背部和骨盆疼痛,穿过输卵管并卡在其他器官的线圈,以及严重的长时间月经,《纽约时报》报道。
成千上万的女性表示,她们因该植入物而严重受伤,她们希望FDA让Essure退出市场,并就其并发症发布公开警告。FDA和拜耳公司都表示,该设备的好处大于风险,《纽约时报》报道。
进一步探索
版权©2015每日健康。保留所有权利。
引用: FDA申请停止销售压力植入物(2015年5月5日),2021年5月3日从//www.puressens.com/news/2015-05-fda-petitioned-sales-essure-implant.html收回
此文件受版权保护。除作私人学习或研究之公平交易外,未经书面许可,任何部分不得转载。本内容仅供参考之用。









用户评论