肿瘤微环境如何导致耐药神经母细胞瘤
洛杉矶儿童医院的研究人员在寻找对抗耐药神经母细胞瘤(NBL)的靶点方面迈出了重要一步,NBL是儿童颅骨外最常见的实体恶性肿瘤。
该研究由儿童癌症和血液疾病中心以及CHLA萨班研究所的Muller Fabbri医学博士领导,并发表在国家癌症研究所杂志5月13日,该研究观察了肿瘤环境中释放的外泌体mirna如何影响化疗耐药性。
外泌体是囊泡,或“包膜”,运送它们的货物microRNA (miRNA) -小分子,不能转化为工作蛋白质,但可以调节基本的细胞过程。例如,mirna在通过抑制或关闭基因来调节蛋白质生产方面很重要。
Fabbri说:“成神经细胞瘤复发的主要原因——基本上是所有类型的癌症——是对化疗等治疗的抵抗力不断增长。”Fabbri同时就职于南加州大学凯克医学院诺里斯癌症中心。“这项研究的目标是评估外泌体miRNAs是否以及在多大程度上参与了耐药性的发展肿瘤微环境."
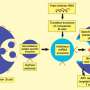
在肿瘤微环境中,癌症生长,获得转移能力并对治疗产生耐药性,有很多交叉对话。外泌体通过在NBL细胞和邻近的单核细胞之间传递信息,参与细胞间的通信白细胞它们是人体先天免疫系统的一部分。
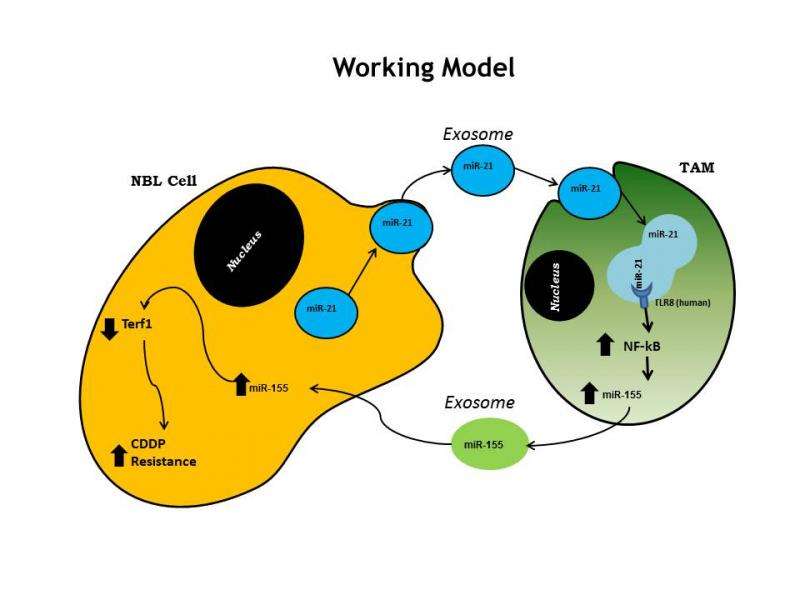
TAMs -肿瘤相关巨噬细胞-也被发现在肿瘤附近,并来源于循环单核细胞。根据癌症的类型,TAMs具有促肿瘤和抗肿瘤两种功能。在NBL中,它们代表了一个负面的预后因素,CHLA的科学家们假设TAMs以某种方式通过外泌体mirna的交换影响了化疗的耐药性。
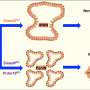
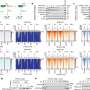
科学家们发现特定的mirna在肿瘤和TAMs之间交换(通过外泌体“信封”),并发现了癌细胞释放这些信封和TAMs接收它们的过程。这种交换的结果是,一种被称为MiR155的特殊microRNA,在肿瘤中可见到高水平,被上调。然而,当研究人员在癌细胞系中寻找MiR155的表达时,它的表达低得惊人。事实证明,这是因为MiR155不是来自癌细胞系,而是来自肿瘤微环境,并由外泌体分泌回癌细胞,在那里它沉默了一个重要的基因——TERF1。
TERF1在整个细胞周期中存在于端粒(有助于确定细胞如何衰老的人类细胞的重要部分)中,并作为端粒酶(一种在肿瘤中发现的酶)的抑制剂发挥作用。正常细胞的端粒就像一个“内部时钟”,测量细胞何时衰老和应该死亡;在癌细胞中,端粒酶的高活性不断重置这个时钟。
Fabbri解释说:“因此,即使癌细胞应该死亡,它们也会继续存活。”他补充说,端粒酶活性高是癌症的一个标志,而TERF1蛋白水平在对化疗有抗性的癌细胞中很低。
当MiR155通过外泌体传递时,它会抑制TERF1,导致端粒酶活性增加,对化疗的耐药性增加。研究人员得出结论,如果能够阻断这种串音——本质上是阻止外泌体向癌细胞的“邮件传递”——癌细胞将在化疗的存在下再次开始死亡。
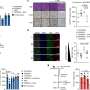
他们在体外和体内测试了他们的假设,使用含有miR155的人造外泌体,并用已知的抑制外泌体产生的分子(GW4869)阻断它们。他们观察到他们怀疑会发生的事情——更多癌症细胞因为外泌体传递系统被阻断而死于化疗。此外,由于这一过程,他们没有在动物模型中观察到毒性。下一步是找出如何只阻断那些携带使TERF1沉默的货物的外泌体,而不是那些“好的”信使——因为通过外泌体交换信息也发生在相互之间正常细胞.
Fabbri说:“通过发现TAMs如何恶化成神经细胞瘤患者预后背后的复杂分子机制,我们现在知道了该针对什么。”