研究人员在发起劳动的胎儿内发现分子机制
德克萨斯大学西南医学中心(UT Southwestern Medical Center)的研究人员在胎儿肺部发现了两种负责启动分娩过程的蛋白质,为防止早产提供了潜在的新靶点。
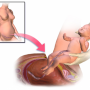
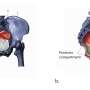
先前的研究表明,来自胎儿的信号启动了生产过程,但导致分娩的确切分子机制仍不清楚。UT西南大学的生物化学家通过研究小鼠模型发现,类固醇受体共激活因子1和2 (SRC-1和SRC-2)这两种蛋白是促进分娩开始的肺表面活性物质成分的控制基因。表面活性剂是胎儿出生前肺部释放的一种物质,对子宫外的正常呼吸至关重要。
“我们的研究提供了令人信服的证据表明胎儿调节其出生的时间,并且这种控制在这两个基因调节蛋白-SRC-1和SRC-2之后发生 - 增加表面活性剂组分,表面活性剂蛋白A和血小板活化因子,“高级作者Carole Mendelson博士说,生物化学教授,UT Southwestern的妇产科和妇科。
“通过了解在40周时开始正常足月分娩的因素和途径,我们可以更深入地了解如何预防早产,”德克萨斯大学西南分校(UT Southwestern)北德克萨斯畸胎儿出生缺陷研究中心(North Texas March of Dimes Birth defect Center)主任Mendelson博士说。
根据美国疾病控制与预防中心(Centers for Disease Control and Prevention)的数据,美国每年约有九分之一的婴儿早产(不到37周)。早产会导致婴儿脑出血和呼吸困难,以及脑瘫、慢性肺部疾病和视力受损等长期状况。
这项研究发表在临床调查杂志,得到了国家卫生研究院的支持,并从Dimes Foundation的3月份获得了最活力的研究倡议补助金。
UT Southwestern研究人员发现,蛋白质SRC-1和SRC-2在胎儿肺部内的全术语内激活基因,导致表面活性剂组分的产生增加,表面活性剂蛋白A(SP-A)和血小板活化因子(PAF)。然后将SP-A和PAF分泌到胎儿的肺部进入羊水,导致母亲的子宫中引发劳动力的炎症反应。
目前的研究表明,SRC-1和SRC-2中的缺乏胎儿'肺部大大降低了SP-A和PAF的生产,导致小鼠模型中的一个至两年的劳动延迟,与三到四周相当劳动延迟妇女。
研究人员进一步发现,将SP-A或PAF注射到缺陷小鼠的羊水中,可以让母亲按时分娩。总之,这些发现进一步定义了胎儿控制出生时间的潜在分子机制。
未来的研究包括定义胎儿信号如何传递给母亲的子宫,并将这些发现与原因相关联早产。
进一步探索






用户评论