潜在的药物减少帕金森病模型中的神经变性

哺乳动物模型的第一次测试,治疗帕金森病的潜在新药物疾病,显示了在伯明翰和普诚公司的阿拉巴马大学的测试大鼠大学中的神经变性的减少,在伯明翰和辉瑞公司的研究人员在线报告生物化学杂志。
目前,没有疗法缓慢或阻止帕金森病的进展,常见的神经变性疾病,影响全世界700万到1000万人。
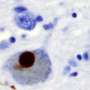
这大鼠模型过表达大脑一侧的蛋白质α-突触核蛋白。这导致多巴胺产生的退化神经元大脑的真实性NIGRA地区。
“因为我们的观察范围仅限于为期四周的时间,我们不确定神经变性与α-突触核蛋白有关真正防止或只是延迟,“高级作者安德鲁西,博士和同事写道。”无论如何,与帕金森病相关的任何中断都可能代表着重要的治疗进程。“
“对于60年代中期患有疾病发病的患者,帕金森病的疗程超过10到15年,”西部的神奇遗传学和实验治疗中心的联合主任和John A.和Ruth R.JurenkoUAB神经内科教授。“所以,如果我们甚至可以减缓疾病,鉴于可用的有症状治疗,那么可能会有效地与固化一样好。”
大鼠模型用来模仿帕金森病的两种主要特征:大脑中多巴胺神经元的退化,以及存活神经元中α-突触核蛋白的积累。帕金森患者在实质性NIGRA中具有显着退化的多巴胺能神经元,其疾病的中期阶段高达70%,而且许多患者中α-突触核蛋白的异常积累。帕金森如何开始以及如何进展仍不清楚。
潜在的新类药物是激酶抑制剂,其对酶“富氨氨酸的重复激酶2”(LRRK2,发音为“Lark二”)。两个线索指向LRRK2作为帕金森治疗的可能目标。首先,约2%的帕金森病患者在LRRK2中具有特异性突变,称为G2019S,增加了LRRK2的激酶活性;这表明增加的活动在疾病的进展中起着作用。其次,去年西方实验室报告说,没有LRRK2的基因“淘汰”大鼠在α-突触核蛋白过表达模型中完全免受神经变性的影响,表明药理学抑制可能是一种可行的方法。
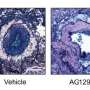
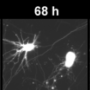
该模型使用表达克隆人G2019S-LRRK2基因的大鼠。然后将这些大鼠注射在大脑中(特别是大脑的一部分称为Indicaia nigra),其病毒表达人α-突触核蛋白。在感染时从测试大鼠喂食测试抑制剂四周。小分子抑制剂容易通过血脑屏障,从血液中到达脑。除了保护神经变性之外,抑制剂还通过与G2019S-LRRK2表达相关联的脑中观察到的小胶质细胞的炎症反应。
西部和同事还测试了来自具有人G2019S-LRRK2的脱离,野生型大鼠的抑制剂,这些动物与具有人G2019S-LRRK2的菌株不同。随着安慰剂,这些大鼠在α-突触核蛋白过表达四周后显示出约20%的神经元损失;但是用抑制剂的治疗完全减少了这种损失。该结果表明,抑制剂在没有人G2019S-LRRK2的情况下也具有功效。
“这很重要,因为只有2%的帕金森病患者有G2019S突变,”西说。“这些野生型大鼠真正激动我们,因为它表明药物的治疗作用可能延伸到大多数帕金森病患者。这使我们与PFizer Inc.和Michael J. Fox基金会进行了帕金森研究的迈克尔J.Fox基金会。更多努力LRRK2抑制剂。“
辉瑞抑制剂是药品公司开发的许多LRRK2抑制剂之一,也与南方研究所合作。西方表示,如果这类药物在初始临床试验中显示出初步临床试验的承诺,这将有几种不同的抑制剂的空间,希望将在明年内发生。
辉瑞抑制剂的下一步骤将测试各种剂量并测试如果在α-突触核蛋白表达式开始后的处理开始,则会测试发生的情况。西部注意到,帕金森病的任何可能治疗都需要非常安全,因为治疗持续多年。
“我们必须非常小心,我们的模型可以告诉我们,”West警告关于从大鼠模型推断。“我们需要批判地思考我们可以期望在人类中看到什么类型的好处,因为最近的临床试验设计妨碍了几年,有时几十年的新毒品的发展。”
例如,目前尚不清楚抑制剂在大鼠模型中的作用,特别是由于大脑中的炎性小胶质细胞也表达了LRRK2。了解这些信息对于诊所的这些药物的成功可能是至关重要的。在单独的证据之路中,包括David Standaert,M.D.,Ph.D的研究人员,发现了几种神经炎性过程的基因敲除可以阻断α-突触核蛋白神经变性。因此,抑制剂可能对神经元或仅限微胶质产生影响,或者它可能是影响神经元和小胶质细胞的双击过程。STANTAERT是UAB神经内科系的John N. Whitaker教授和主席。
进一步探索






用户评论