严重不良事件在健康志愿者参与第一阶段药物试验
许多人认为第一阶段试验与健康志愿者非常危险,因为他们带来风险,没有利益,不道德的。但是这些试验有多危险?不到1%的11000名健康志愿者参与394年第一阶段试验新药经历了严重的并发症,根据一项新的分析参与者的非癌,第一阶段的药物试验。此外,所有的志愿者死亡或遭受持续的障碍与试验药物有关。规模最大的此类研究中,研究人员发现只有34(0.31%)与严重不良事件健康志愿者,这是由美国食品及药物管理局为那些导致死亡;危及生命;需要住院治疗或延长住院;或导致残疾,先天性畸形或先天缺陷。和一半的严重不良事件,如登革热或影响志愿者服用安慰剂,没有与我试验药物或研究过程的阶段。尽管每年超过100000健康人群参与non-oncology第一阶段的研究在世界范围内,几乎没有系统研究量化风险。 However, this study, led by researchers at the Perelman School of Medicine at the University of Pennsylvania and published in英国医学杂志,发现的风险非常低。
“研究结果提供良好支持的一般安全第一阶段试验,”主要作者以西结说j·伊曼纽尔,医学博士,博士,部门的主席宾夕法尼亚大学医学伦理和卫生政策。“有些人声称这些试验造成高风险伤害的参与者。但从本质上说,这些发现表明这样的声明没有实证效度。”Overall, there were three serious不良事件每1000个参与者,与几个发生在受试者服用安慰剂和其他评价与研究药物无关或研究过程。
荟萃分析研究了394常見,第一阶段的研究包括11028名健康、补偿、自愿参与者(4620独特的个体,他们中的一些人参与多个研究)进行了2004年9月至2011年3月在辉瑞公司的年代三个全球专用的第一阶段测试网站在比利时、新加坡和美国。在第一阶段试验中,研究人员测试一种新的药物或治疗在一小群人第一次来评估其安全性,确定一个安全剂量范围,并确定副作用。
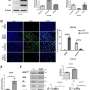
研究人员发现,63.7%的参与者经历了总共24643个不良事件,和另外的36.3%没有任何的不良事件。近四分之一(24.1%)的被判定为不良事件与研究药物无关,和绝大多数(84.6%)的不良事件归类为轻度,14.4%,中等,1%为严重。“温和”分类意味着症状不干扰正常运转而严重不良事件与主题的基本日常运作影响显著;例如,一个手指也断了。最常见的不良事件是头痛(12.2%)、嗜睡(9.8%)、腹泻(6.9%)、呕吐(5.9%)、眩晕或头晕(5.4%)、呕吐(2%)。
严重不良事件的例子包括胸痛、视力模糊、酶水平升高,腹部疼痛和痉挛。34的严重不良事件,11个相关研究药物和七个学习过程,而16无关药物或手术的一项研究中,参与者包括四个发生在接受安慰剂。共有143例(36%)研究涉及安慰剂,10.3%的不良事件(2528)发生在参与者接受安慰剂。近20%的不良事件发生在这项研究的第一天。这些都是假设是与行为的变化要求参加一项研究,如退出吸烟和饮酒或含咖啡因的饮料,而不是从研究药物。
“有些人可能会质疑这些数据的可靠性,因为不良事件被调查人员确定和分类的制药公司,”伊曼纽尔说。“但这是不可能的。有几个原因。首先,超过24000个不良事件报告。第二,给参与者的知情同意文件鼓励他们在多个地方报告健康然而轻微的变化。第三,它不是在制药公司的利益最小化记录以来的不良事件必须做出决定是否进行额外的昂贵的临床研究。最后,对第一阶段的研究人员工资或奖金辉瑞不依赖的结果阶段我研究,所以没有金融激励‘欺骗’。”